题目内容
19.已知肼(N2H4)是一种高能燃料,1mol气态肼与O2反应生成气态水和气体单质时放出QkJ的热量,已知断裂1mol化学键所需的能量(kJ):N≡N为a、O=O 为 b、N-N 为 c,H-O 为 d,则断裂1molN-H键所需的能量(kJ)是( )| A. | $\frac{(a+4d-Q-b-c)}{4}$ | B. | $\frac{(a+2d+Q-b-c)}{4}$ | C. | $\frac{(a+2d-Q-b-c)}{4}$ | D. | $\frac{(a+2d+Q-b-c)}{4}$ |
分析 发生N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H=断裂化学键吸收的能量减去成键释放的能量,以此来解答.
解答 解:断裂1mol化学键所需的能量(kJ):N≡N为a、O=O 为 b、N-N 为 c,H-O 为 d,设断裂1molN-H键所需能量为x,
N2H4 (1)+O2(g)=N2(g)+2H2O(g)的△H=断裂化学键吸收的能量减去成键释放的能量,
1mol气态肼与O2反应生成气态水和气体单质时放出QkJ的热量,
则4x+c+b-(a+d×2×2)=-Q,
解得x=$\frac{(a+4d-Q-b-c)}{4}$,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意判断物质中化学键数目,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
14.下列推断合理的是( )
| A. | 单质$\stackrel{+O_{2}}{→}$ 氧化物 $\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐,能按照上述转化关系直接转化的可以是硫元素 | |
| B. | 某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| C. | 浓硫酸有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- |
11.从柑橘中可提炼得1,8萜二烯( ).下列有关它的说法不正确的是( )
).下列有关它的说法不正确的是( )
 ).下列有关它的说法不正确的是( )
).下列有关它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 分子中所有碳原子可能共平面 | ||
| C. | 其一氯代物有9种 | D. | 能与溴水发生加成反应 |

 反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中 进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:
反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中 进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题: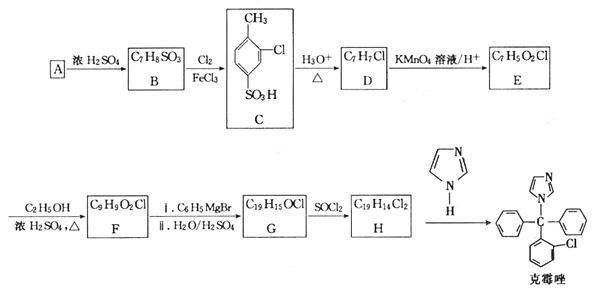

 .
. +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl. 、
、 .
. 的合成路线.
的合成路线. 4-甲基-3-乙基-2-己烯;
4-甲基-3-乙基-2-己烯;  2,2,3-三甲基戊烷;
2,2,3-三甲基戊烷; 1,4-二乙基苯.
1,4-二乙基苯. .
.