题目内容
某回收废料中含Al2O3、Fe2O3、Co2O3?CoO多种金属氧化物,某 实验室科技人员欲将之分离并制备有关物质,设计流程如图所示:
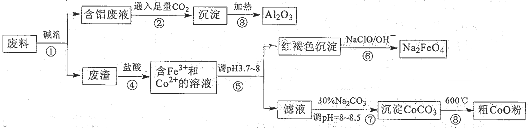
(1)过程②的离子方程式为 .
(2)过程④会产生有毒气体,反应的化学方程式为 .
(3)过程⑥用于制备绿色水处理剂,反应的离子方程式为 .
(4)过程⑦中碳酸钠溶液起的作用是 .
(5)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水.下表是粉红色的CoCl2?6H2O晶体受热分解时的情况:
认真分析以上数据,填写下列空白.③物质的化学式是 .写出CoCl2?6H2O晶体受热分解生成②的化学方程式 .

(1)过程②的离子方程式为
(2)过程④会产生有毒气体,反应的化学方程式为
(3)过程⑥用于制备绿色水处理剂,反应的离子方程式为
(4)过程⑦中碳酸钠溶液起的作用是
(5)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水.下表是粉红色的CoCl2?6H2O晶体受热分解时的情况:
| 温度/℃ | 32 | 52 | 90 | 120 |
| 固体质量/g | ① | 83 | 74 | 65 |
| 固体物质化学式 | CoCl2?6H2O | ② | ③ | CoCl2 |
考点:金属的回收与环境、资源保护,镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:(1)废料通过碱液得到的含铝废液是含偏铝酸根的废液,故通二氧化碳是偏铝酸根生成氢氧化铝沉淀;
(2)根据过程④会产生有毒气体结合反应物Fe2O3、Co2O3?CoO与盐酸反应,因为Fe2O3与盐酸反应生成氯化铁和水,所以只有Co2O3?CoO与盐酸反应产生有毒气体即氯气,再根据氧化还原反应特征说明Co2O3?CoO在反应中化合价减低,最后结合反应④后的产物书写;
(3)根据红褐色沉淀即氢氧化铁在碱性条件下与次氯酸钠反应生成高铁酸钠,再结合氧化还原反应的特征书写;
(4)根据过程⑦的前后变化不难判断碳酸钠的作用;
(5)根据关系式CoCl2?6H2O~CoCl2求出CoCl2?6H2O的质量,然后再根据差量法求出②和③物质的化学式.
(2)根据过程④会产生有毒气体结合反应物Fe2O3、Co2O3?CoO与盐酸反应,因为Fe2O3与盐酸反应生成氯化铁和水,所以只有Co2O3?CoO与盐酸反应产生有毒气体即氯气,再根据氧化还原反应特征说明Co2O3?CoO在反应中化合价减低,最后结合反应④后的产物书写;
(3)根据红褐色沉淀即氢氧化铁在碱性条件下与次氯酸钠反应生成高铁酸钠,再结合氧化还原反应的特征书写;
(4)根据过程⑦的前后变化不难判断碳酸钠的作用;
(5)根据关系式CoCl2?6H2O~CoCl2求出CoCl2?6H2O的质量,然后再根据差量法求出②和③物质的化学式.
解答:
解:(1)废料通过碱液得到的含铝废液是含偏铝酸根的废液,故通二氧化碳是偏铝酸根与二氧化碳反应生成氢氧化铝沉淀,所以离子方程式为
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)根据过程④会产生有毒气体结合反应物Fe2O3、Co2O3?CoO与盐酸反应,因为Fe2O3与盐酸反应生成氯化铁和水,所以只有Co2O3?CoO与盐酸反应产生有毒气体即氯气,再根据化合价变化说明Co2O3?CoO在反应中化合价减低,最后结合反应④后的产物为+2Co;所以化学方程式为:Co2O3?CoO+8HCl=CoCl2+3Cl2↑+4H2O,
故答案为:Co2O3?CoO+8HCl=3CoCl2+Cl2↑+4H2O;
(3)根据红褐色沉淀即氢氧化铁在碱性条件下与次氯酸钠反应生成高铁酸钠,所以离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(4)根据过程⑦的前后变化发现是沉淀CoCO3,所以作用为调节PH值,提高碳酸根,使+2Co沉淀为CoCO3;
故答案为:调节PH值,提高碳酸根,使+2Co沉淀为CoCO3;
(5)CoCl2?6H2O~CoCl2
238 130
m 65g
=
解得:m=119g
②物质的化学式为CoCl2?nH2O,则有:
CoCl2?6H2O~CoCl2?nH2O△m
238 18(6-n)
119g 119g-83g
=
,解得:n=2,
所以②物质的化学式为:CoCl2?2H2O,
同理③物质的化学式为CoCl2?aH2O,则有:
CoCl2?6H2O~CoCl2?aH2O△m
238 18(6-a)
119g 119g-74g
=
,解得:a=1,
所以③物质的化学式为:CoCl2?H2O;
故答案为:CoCl2?H2O;CoCl2?6H2O
CoCl2?2H2O+4H2O.
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)根据过程④会产生有毒气体结合反应物Fe2O3、Co2O3?CoO与盐酸反应,因为Fe2O3与盐酸反应生成氯化铁和水,所以只有Co2O3?CoO与盐酸反应产生有毒气体即氯气,再根据化合价变化说明Co2O3?CoO在反应中化合价减低,最后结合反应④后的产物为+2Co;所以化学方程式为:Co2O3?CoO+8HCl=CoCl2+3Cl2↑+4H2O,
故答案为:Co2O3?CoO+8HCl=3CoCl2+Cl2↑+4H2O;
(3)根据红褐色沉淀即氢氧化铁在碱性条件下与次氯酸钠反应生成高铁酸钠,所以离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(4)根据过程⑦的前后变化发现是沉淀CoCO3,所以作用为调节PH值,提高碳酸根,使+2Co沉淀为CoCO3;
故答案为:调节PH值,提高碳酸根,使+2Co沉淀为CoCO3;
(5)CoCl2?6H2O~CoCl2
238 130
m 65g
| 238 |
| m |
| 130 |
| 65 |
②物质的化学式为CoCl2?nH2O,则有:
CoCl2?6H2O~CoCl2?nH2O△m
238 18(6-n)
119g 119g-83g
| 238 |
| 119 |
| 18(6-n) |
| 119-83 |
所以②物质的化学式为:CoCl2?2H2O,
同理③物质的化学式为CoCl2?aH2O,则有:
CoCl2?6H2O~CoCl2?aH2O△m
238 18(6-a)
119g 119g-74g
| 238 |
| 119 |
| 18(6-a) |
| 119g-74g |
所以③物质的化学式为:CoCl2?H2O;
故答案为:CoCl2?H2O;CoCl2?6H2O
| ||
点评:本题考查了金属及其化合物的性质,考查氧化还原反应、离子反应、关系式计算等,难度中等,关键根据实验流程利用氧化还原反应判断书写发生的离子反应,是对学生综合能力的考查.是一道不错的能力考查题.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氢氧化钡与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、氯化铝溶液与过量氨水反应:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
能证明SO2具有漂白性的是( )
| A、溴水中通入SO2气体后溶液褪色 |
| B、酸性KMnO4溶液中通入SO2气体后溶液褪色 |
| C、品红溶液中通入SO2气体后溶液褪色 |
| D、滴有酚酞的NaOH溶液中通入SO2气体后溶液褪色 |
NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA |
| B、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
| C、含有4 NA个碳碳σ键的金刚石,其质量为24 g |
| D、含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是( )
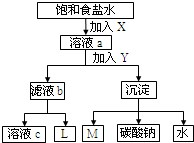

| A、若是氨碱法,溶液c可在转化流程中循环利用 |
| B、若是联碱法,则L的主要成分是NH3 |
| C、M可在转化流程中循环利用 |
| D、X是NH3,Y是CO2 |
一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件时,有关叙述错误的是( )
| A、加催化剂,V正、V逆都发生变化,且变化的倍数相等,平衡不移动 |
| B、加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数,平衡正移 |
| C、降温,V正、V逆都减小,且V逆减小的倍数小于V正减小的倍数,平衡逆移 |
| D、减少氨气的浓度,V正不变,V逆减小,且平衡向正反应方向移动 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A、一定不存在Ba2+,NH4+可能存在 |
| B、一定不存在Cl- |
| C、一定存在Na+ |
| D、可能存在Cl-、Na+ |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |