题目内容
12.下列说法正确的是( )| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 在铁上镀铜,应选用铜作阴极 |
分析 A.MgO的熔点较高;
B.反应热的大小与反应的途径无关,只与反应的始态和终态有关;
C.惰性电极电解Na2SO4溶液,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气;
D.电镀时,镀层金属作阳极.
解答 解:A.工业上常用电解熔融MgCl2制备金属镁,不电解熔融的MgO,故A错误;
B.CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,故B正确;
C.惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故C错误;
D.电镀时,镀层金属作阳极,则在铁上镀铜,应选用铜作阳极,故D错误.
故选B.
点评 本题考查了金属的冶炼、盖斯定律的含义、原电池、电解池原理的分析应用,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,注意把握电解名称、电极反应和电极产物的分析判断,题目较简单.

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
3.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.
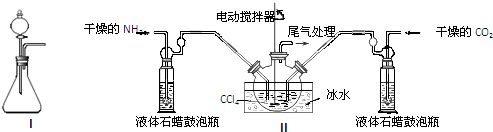
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品6.58g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为3.94g.则样品中氨基甲酸铵的质量分数为76%..
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.

注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
20.化学与人类生活、能源开发、资源利用等密切相关.下列说法正确的是( )
| A. | 聚氯乙烯塑料制品可用于食品包装 | |
| B. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| C. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
17.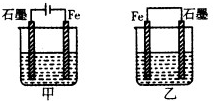 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )| A. | A、甲乙两装置中的石墨电极分别是阴极、负极 | |
| B. | 铁棒的腐蚀程度:甲>乙 | |
| C. | 石墨电极上发生反应的电极反应式相同 | |
| D. | 溶液的pH:甲减小,乙增大 |
1.下列电离方程式中,正确的是( )
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
2.一份100ml 0.2mol/L的NaCl溶液,下列哪个选项与该溶液中的Cl-浓度相同( )
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
 )与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空: 或
或 .
. .
. 与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为
与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由A生成对溴苯乙烯的反应条件为浓硫酸、加热.
.由A生成对溴苯乙烯的反应条件为浓硫酸、加热. Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行: