题目内容
18.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O,下列说法正确的是( )| A. | 混合气体一定是CH4和C2H4 | |
| B. | 混合气体中一定有CH4,可能含有C2H4 | |
| C. | 混合气体中一定含有CH4,可能含有C2H6 | |
| D. | 混合气体中可能含有C2H2 |
分析 反应生成的3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而碳原子数小于1.6的只有甲烷,则一定含有甲烷,然后根据平均分子式进行判断.
解答 解:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,混合烃的平均分子式为C1.6H4;
烃中C原子数小于1.6的只有CH4,则混合气体中一定含有CH4,由于CH4分子中含4个H原子,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是C2H4或C3H4,
A.根据以上分析可知,混合气体中一定含有CH4,可能存在C2H4,故A错误;
B.混合气体中一定含有CH4,可能含有C2H4,即不一定含有乙烯,故B正确;
C.由于氢原子平均为4,则另一种烃分子中一定含4个H原子,所以混和气体中一定没有C2H6,故C错误;
D.混合烃的平均分子式为:C1.6H4,烃中C原子数小于1.6的只有CH4,则一定含有CH4,CH4分子中含4个H原子,故另一种分子中一定含4个H原子,则一定没有乙炔,故D错误;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,解答关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,注意掌握平均分子式法在确定有机物组成中的应用方法.

练习册系列答案
相关题目
8.下列过程涉及化学变化的是( )
| A. | 碘的升华 | B. | 石油分馏 | ||
| C. | 用苯萃取溴水中的溴 | D. | 煤的干馏 |
9.俗话说:“滴水之恩当涌泉相报”,自然界中的泉水属于( )
| A. | 纯净物 | B. | 混合物 | C. | 单质 | D. | 不能确定 |
6.化学与生活息息相关,以下说法不正确的是( )
| A. | 集中处理废旧电池,以防止重金属污染环境 | |
| B. | 海产品中加入大量甲醛以延长保鲜期 | |
| C. | 食用蔬菜水果可以补充人体所需维生素 | |
| D. | 使用加碘盐,可预防因缺碘引起的甲状腺肿大 |
13.下列各组金属混合物的质量相同,它们分别与足量盐酸反应,在相同状况下产生的氢气体积也相同,则其中含铝的质量最少的是( )
| A. | 铁和铝 | B. | 锌和铝 | C. | 镁和铝 | D. | 铜和铝 |
3.下列反应属于氧化还原反应的是( )
①Na2O2+2H2O═2NaOH+H2O2
②IBr+H2O═HIO+HBr
③Cr2O72-+4H2O2+2H+═2CrO5+5H2O(CrO5的结构为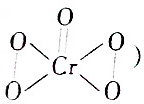 )
)
①Na2O2+2H2O═2NaOH+H2O2
②IBr+H2O═HIO+HBr
③Cr2O72-+4H2O2+2H+═2CrO5+5H2O(CrO5的结构为
 )
)| A. | ①②③ | B. | ② | C. | ③ | D. | 都不是 |
10.假设12C的相对原子质量为24,则下列推断中,不正确的是( )
| A. | 标准状况时11.2LO2的质量为32g | B. | 16O的相对原子质量为32 | ||
| C. | 44gCO2和28gCO含有相同的分子数 | D. | 标准状况时44gCO2的体积是22.4L |
16.现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).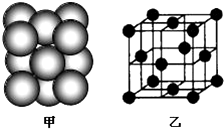
| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).