题目内容
15.计算pH=2的H2SO4溶液中由H2O电离的c(OH-)=10-12mol•L-1.分析 pH=2的H2SO4溶液中H+来源有两个:H2SO4的电离和H2O的电离,而OH-只来源于水.应先求算c(OH-),即为水电离的c(H+)或c(OH-),根据Kw=c(H+)×c(OH-)计算即可.
解答 解:pH=2的H2SO4溶液中H+来源有两个:H2SO4的电离和H2O的电离,而OH-只来源于水,根据Kw=c(H+)×c(OH-),由H2O电离的c(OH-)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol•L-1.
故答案为:10-12 mol•L-1.
点评 本题考查学生水溶液中Kw=c(H+)×c(OH-)的计算公示的应用知识,注意基本知识的理解和迁移应用,难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
5.用图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量.下列叙述错误的是( )
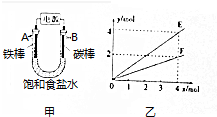

| A. | E表示反应生成NaOH的物质的量 | B. | E表示反应消耗H2O的物质的量 | ||
| C. | F表示反应生成H2或Cl2的物质的量 | D. | F表示反应消耗NaCl的物质的量 |
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 常温常压下,0.01mol Na2CO3含有的Na+离子数为 0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为 22.4L | |
| D. | 物质的量浓度为 0.5mol/L 的 MgCl2溶液中,含有Cl- 个数为NA |
3.材料是人类赖以生存和发展的重要物质基础.有机高分子材料的出现是材料发展史上的一次重大突破.下更物质中含有有机高分子材料的是( )
| A. | 普通水泥 | B. | 普通玻璃 | C. | 汽车轮胎 |
7.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2是气体,SiO2是固体 | |
| B. | 二氧化硅的熔点比二氧化碳高 | |
| C. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| D. | CO2通入Na2SiO3溶液中析出硅酸沉淀 |
4.下列说法正确的是( )
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红 | |
| B. | Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同 | |
| C. | 只存在共价键的物质一定是共价化合物、离子化合物中一定含有离子键 | |
| D. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 |
5.下列关于乙烯的叙述中正确的是( )
| A. | 乙烯分子中两个碳原子和四个氢原子在同一个平面上 | |
| B. | 乙烯是易溶于水的气体 | |
| C. | 乙烯燃烧时火焰的亮度比甲烷燃烧时暗 | |
| D. | 聚乙烯的结构简式为(CH2=CH2)n |
