题目内容
13.近年来特大地震灾害频繁发生,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.工业上制漂白粉有以下工序:(1)海水晒盐.
(2)粗盐提纯:粗盐中主要含有MgCl2、Na2SO4和CaCl2杂质,设计如下方案:
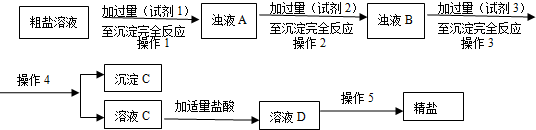
①试剂1~试剂3依次为:BaCl2、Na2CO3、NaOH(填Na2CO3、NaOH或者BaCl2)
②沉淀C含有BaSO4、Mg(OH)2还有CaCO3、BaCO3(用化学式表示).
(3)电解法制氯气:观察图1,回答:
①电解反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
②若饱和食盐水中含有酚酞,通电后铁棒(填铁棒或石墨棒)
附近变红.图中b端产生的气体如何检验用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气
(4)制取漂白粉:
a.将氯气通入石灰乳[Ca(OH)2]中反应,化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
b.在①漂白粉 ②MgCl2③盐酸 ④氯气 ⑤铁 ⑥Na2O⑦稀硫酸 ⑧CO2 ⑨液氨 ⑩酒精 中属于电解质的是②⑥(填序号,下同),属于非电解质的是⑧⑨⑩.
(5)实验室加热MnO2和浓盐酸混合物来制取氯气.
①在如图2的各装置中,选用必要的装置,制备纯净干燥的Cl2,并按从左到右的顺序连接仪器,用接口字母按顺序连接为:fbcdeihg.(图2装置不一定全部都使用)
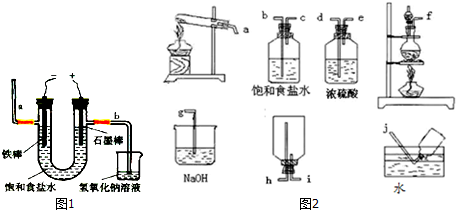
②若将制得的Cl2通入碘化钠溶液中,现象是溶液由无色变为棕黄色,再往其中滴加四氯化碳振荡、静置,现象是溶液分层,上层为接近无色,下层为紫红色.
分析 (2)粗盐中主要含有MgCl2、Na2SO4和CaCl2杂质,根据题中提供的试剂,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,据此答题;
(3)电解法制氯气,是电解食盐水生成氢氧化钠、氢气、氯气,在电解池的阳极产生氯气,阴极产生氢气,同时有氢氧化钠产生,据此答题;
(4)工业上制漂白粉是用氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,据此将物质分类;
(5)①实验室加热MnO2和浓盐酸加热制氯气,由于氯化氢易挥发,所以制得的氯气中含有氯化氢和水份,所以制得的氯气通过饱和食盐水除氯化氢,再通过浓硫酸干燥得纯净氯气,制得的氯气可排空气法收集,尾气用氢氧化钠溶液吸收;
混合物来制取氯气.
②氯气能置换出碘化钾中的碘,碘易溶于四氯化碳,四氯化碳的密度大于水,据此判断反应现象.
解答 解:(2)粗盐中主要含有MgCl2、Na2SO4和CaCl2杂质,根据题中提供的试剂,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,
①根据上面的分析可知,试剂1~试剂3依次为:BaCl2、Na2CO3、NaOH(答案不唯一,只要Na2CO3在BaCl2之后),
故答案为:BaCl2、Na2CO3、NaOH(只要Na2CO3在BaCl2之后);
②沉淀C含有BaSO4、Mg(OH)2还有CaCO3、BaCO3,
故答案为:CaCO3、BaCO3;
(3)电解法制氯气,是电解食盐水生成氢氧化钠、氢气、氯气,在电解池的阳极产生氯气,阴极产生氢气,同时有氢氧化钠产生,
①电解反应的化学方程式为 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
②电解食盐水时,铁做阴极,石墨棒做阳极,氢氧化钠在阴极即铁棒附近产生,所以通电后 铁棒附近变红,图中b端产生氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气,
故答案为:铁棒;用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气;
(4)工业上制漂白粉是用氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,所以在上述物质中属于电解质的是②⑥,属于非电解质的是⑧⑨⑩,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;②⑥;⑧⑨⑩;
(5)①实验室加热MnO2和浓盐酸加热制氯气,由于氯化氢易挥发,所以制得的氯气中含有氯化氢和水份,所以制得的氯气通过饱和食盐水除氯化氢,再通过浓硫酸干燥得纯净氯气,制得的氯气可排空气法收集,尾气用氢氧化钠溶液吸收,所以实验装置按从左到右的顺序连接仪器,用接口字母按顺序连接为:f b c d e i h g,
故答案为:f b c d e i h g;
②氯气能置换出碘化钾中的碘,Cl2通入碘化钠溶液中,现象是溶液由无色变为棕黄色,碘易溶于四氯化碳,四氯化碳的密度大于水,所以滴加四氯化碳振荡、静置,现象是溶液分层,上层为接近无色,下层为紫红色,
故答案为:溶液由无色变为棕黄色;溶液分层,上层为接近无色,下层为紫红色.
点评 本题考查了粗盐的提纯、氯气制备、除杂、漂白粉的制备等内容,注意除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,题目难度中等,注意元素化合物知识在实验分析中的灵活运用.

 阅读快车系列答案
阅读快车系列答案| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| A. | 限制生产含磷洗衣剂-防止湖海出现“赤潮” | |
| B. | 严禁排放未经处理的有毒工业废水-防止水土流失 | |
| C. | 不允许焚烧农作物秸秆-防止污染空气 | |
| D. | 限制生产不符合尾气排放标准的汽车-防止氮氧化物污染空气 |
| A. | 冰融化 | B. | 光合作用 | C. | 白炽灯发光 | D. | 焰色反应 |
| A. | Cu2++2OH-═Cu(OH)2↓ CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓ | |
| B. | CO32-+2H+═CO2↑+H2O NaHCO3+HCl═NaCl+CO2↑+H2O | |
| C. | H++OH-═H2O NaOH+HNO3═NaNO3+H2O | |
| D. | SO42-+Ba2+═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O |
| A. | 能量变化是化学反应的基本特征之一 | |
| B. | 需加热的化学反应未必都是吸热反应 | |
| C. | 化学反应中的能量变化只与反应物的状态有关与其质量无关 | |
| D. | 石墨转化为金刚石是吸热反应说明金刚石总能量更高 |
(1)该工艺流程中多处涉及到过滤操作,其需要用到的玻璃仪器主要有烧杯、玻璃棒、(普通)漏斗.
(2)假设所得反应Ⅰ的滤液中各种金属阳离子的浓度均为0.001mol/L( 查数据可知部分难溶物的溶度积Ksp数值如下表所示(25℃))
| 难溶物 | 溶度积Ksp |
| Mg(OH)2 | 1.8×10-11 |
| Al(OH)3 | 1.0×10-33 |
| Fe(OH)3 | 8.0×10-38 |
②当Fe3+恰好沉淀完全时溶液的PH值为3.3.(已知:lg2=0.3)
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
(4)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol/L NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL.
①步骤3中采用饱和KCl溶液洗涤沉淀,其目的是洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失.
②步骤5中判断滴定终点的现象是最后一滴滴入后溶液由无色变为粉红色,且30s不褪色.
③已知样品中SiO2的质量分数可用公式“w(SiO2)=$\frac{15cV×1{0}^{-3}}{a}$×100%”进行计算.
由此分析步骤5中与NaOH标准溶液发生中和反应的酸为B.
A.H2SiO3 B.HF C.H2SiO3和HF D.无法确定

| A. | 达平衡时用O2表示的反应速率为0.25 mol•L-1•min-1 | |
| B. | 第二次达平衡时SO3的体积分数大于$\frac{2}{9}$ | |
| C. | 第一次平衡时反应放出的热量为294.9 kJ | |
| D. | 两次平衡SO2的转化率相等 |