题目内容
16.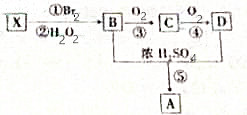 X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得.现以X为主要原料合成一种具有果香味的环状物质A,其合成路线如图所示.其中③、④的催化剂等条件不同;又已知RBr在碱性条件下水解生成ROH.
X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得.现以X为主要原料合成一种具有果香味的环状物质A,其合成路线如图所示.其中③、④的催化剂等条件不同;又已知RBr在碱性条件下水解生成ROH.请分析推断并回答下列问题:
(1)写出C的结构简式:OHCCHO.
(2)A分子中的官能团名称是酯基.
(3)写出⑤的化学方程式:HOOCCOOH+HOCH2CH2OH$→_{△}^{催化剂}$
 +2H2O.
+2H2O.
分析 X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得,应为CH2=CH2,以X为主要原料合成一种具有果香味的环状物质A,A应为 ,则B应为HOCH2CH2OH,C为OHCCHO,D为HOOCCOOH,以此解答该题.
,则B应为HOCH2CH2OH,C为OHCCHO,D为HOOCCOOH,以此解答该题.
解答 解:X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得,应为CH2=CH2,以X为主要原料合成一种具有果香味的环状物质A,A应为 ,则B应为HOCH2CH2OH,C为OHCCHO,D为HOOCCOOH,
,则B应为HOCH2CH2OH,C为OHCCHO,D为HOOCCOOH,
(1)由以上分析可知C为OHCCHO,故答案为:OHCCHO;
(2)A为 ,含有酯基,故答案为:酯基;
,含有酯基,故答案为:酯基;
(3)⑤的化学方程式HOOCCOOH+HOCH2CH2OH$→_{△}^{催化剂}$ +2H2O,
+2H2O,
故答案为:HOOCCOOH+HOCH2CH2OH$→_{△}^{催化剂}$ +2H2O.
+2H2O.
点评 本题考查有机物推断,为高频考点,侧重于考查烯与醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
7.下列物质属于氧化物的是( )
| A. | 水蒸气 | B. | 氯化钠 | C. | 硫酸 | D. | 氢氧化钠 |