题目内容
13. NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:实验Ⅰ.硫代硫酸钠晶体(Na2S2O3•5H2O)的制备:
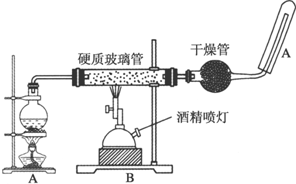
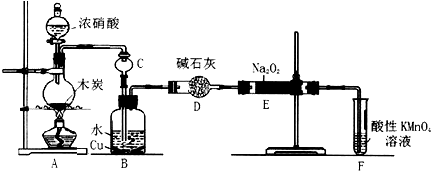
已知Na2S2O3•5H2O对热不稳定,超过48℃即开始丢失结晶水,现以Na2CO3和Na2S物质的量之比为2:1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3•5H2O.
(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入C(填以下选择项的字母),并按下图安装好装置,进行反应.
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色浑浊.反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热.如果通入SO2过量,发生的化学反应方程式为Na2S2O3+SO2+H2O=2NaHSO3+S↓;
实验Ⅱ.产品纯度的检测:
(3)已知:Na2S2O3•5H2O的摩尔质量为248g/mol;2Na2S2O3+I2=2NaI+Na2S4O6.取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液v mL.
①滴定终点的现象是最后滴入一滴碘水,溶液颜色由无色变成蓝色,且半分钟内部褪色;
②该样品纯度是$\frac{4.96×1{0}^{-3}v}{a}×100%$;
(4)滴定过程中可能造成实验结果偏低的是BD;
A.锥形瓶未用Na2S2O3溶液润洗
B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
实验Ⅲ.有毒废水的处理:
(5)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2mL 0.1mol/L 的NaCN溶液的试管中滴加2mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10mL 0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式CN-+S2O32-=SCN-+SO32-.
分析 Ⅰ.(1)以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,根据反应原理可知,蒸馏烧瓶中加入的酸要使反应保持较快的反应速率,浓盐酸、硝酸都易挥发,而稀盐酸加入,反应速率较慢,据此答题;
(2)根据题意,Na2S2O3在酸性条件下会生成S,当溶液中pH接近或不小于7时,如果SO2通过量,会生成NaHSO3,据此书写化学方程式;
II.(3)①淀粉遇碘变蓝色;
②n(I2)=0.010mol/L×(v×10-3 )L=10-5vmol,根据2Na2S2O3+I2=2NaI+Na2S4O6及原子守恒得n(Na2S2O3•5H2O)=n(Na2S2O3)=2n(I2)=2v×10-5mol,m(Na2S2O3•5H2O)=2v×10-5mol×248g/mol=4.96v×10-3g,
其纯度=$\frac{m(N{a}_{2}{S}_{2}{O}_{3}.5{H}_{2})}{样品质量}$×100%;
(4)A.锥形瓶未用Na2S2O3溶液润洗,对实验结果没影响;
B.用碘水滴定Na2S2O3溶液,锥形瓶中溶液变蓝后立刻停止滴定,进行读数,则加入的碘水的量不足;
C.滴定终点时仰视读数,会使读取的数值偏大;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,则读出的标准液的体积偏小;
(5)根据题中实验现象可知,生成的溶液能使 FeCl3溶液呈现血红色,说明有SCN-产生,根据电荷守恒和元素守恒可书写离子方程式.
解答 解:Ⅰ.(1)以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,根据反应原理可知,蒸馏烧瓶中加入的酸要使反应保持较快的反应速率,浓盐酸、硝酸都易挥发,而稀盐酸加入,反应速率较慢,所以用70%的硫酸,故选C;
(2)根据题意,Na2S2O3在酸性条件下会生成S,当溶液中pH接近或不小于7时,如果SO2通过量,会生成NaHSO3,反应的化学方程式为Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案为:Na2S2O3+SO2+H2O=2NaHSO3+S↓;
II.(3)①淀粉遇碘变蓝色,其它物质和淀粉不反应,所以滴定终点现象是:最后滴入一滴碘水,溶液颜色由无色变成蓝色,且半分钟内部褪色,
故答案为:最后滴入一滴碘水,溶液颜色由无色变成蓝色,且半分钟内部褪色;
②n(I2)=0.010mol/L×(v×10-3 )L=10-5vmol,根据2Na2S2O3+I2=2NaI+Na2S4O6及原子守恒得n(Na2S2O3•5H2O)=n(Na2S2O3)=2n(I2)=2v×10-5mol,m(Na2S2O3•5H2O)=2v×10-5mol×248g/mol=4.96v×10-3g,
其纯度=$\frac{m(N{a}_{2}{S}_{2}{O}_{3}.5{H}_{2})}{样品质量}$×100%=$\frac{4.96v×1{0}^{-3}g}{ag}×100%$=$\frac{4.96×1{0}^{-3}v}{a}×100%$,
故答案为:$\frac{4.96×1{0}^{-3}v}{a}×100%$;
(4)A.锥形瓶未用Na2S2O3溶液润洗,对实验结果没影响,故A错误;
B.用碘水滴定Na2S2O3溶液,锥形瓶中溶液变蓝后立刻停止滴定,进行读数,则加入的碘水的量不足,会导致实验结果偏低,故B正确;
C.滴定终点时仰视读数,会使读取的数值偏大,则会使实验结果偏大,故C错误;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,则读出的标准液的体积偏小,会导致实验结果偏低,故D正确,
故选BD;
(5)由题中实验现象可知,生成的溶液能使 FeCl3溶液呈现血红色,说明有SCN-产生,根据电荷守恒和元素守恒可知共离子方程式为CN-+S2O32-=SCN-+SO32-,
故答案为:CN-+S2O32-=SCN-+SO32-.
点评 本题考查物质制备,为高频考点,涉及误差分析、氧化还原反应、方程式的计算、滴定实验等知识点,明确元素化合物性质、化学反应原理及实验操作方法是解本题关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力,易错点是误差分析.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 酸和碱反应生成1mol水时所放出的热 | |
| B. | 1mol酸和1mol碱反应生成盐和水时所放出的热 | |
| C. | 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热 |
| A. | 防止废旧电池重金属盐对土壤水资源造成污染,大力开发废旧电池综合利用技术 | |
| B. | 为减少北方雾霾,作物秸秆禁止直接野外燃烧,研究开发通过化学反应转化为乙醇用作汽车燃料 | |
| C. | 为节约垃圾处理的费用,大量采用垃圾的填埋 | |
| D. | 为减少温室气体排放,应减少燃煤.大力发展新能源,如核能、风能、太阳能 |
(1)写出单质铁在水体中被(O2)氧化腐蚀得到水合氧化铁(FeOOH)的化学方程式:
4Fe+3O2+2H2O=4FeOOH.
(2)某课题组通过查阅文献,进行了用相同单质铁(相同性状和相同质量)在相同时间内,对影响单质铁去除一定量水体中砷的效率的因素提出了以下假设,并进行了实验探究:
假设1:水样的pH;
假设2:水体中所含其他物质及离子;
假设3:水体中的溶解氧;
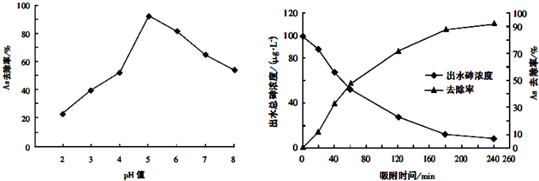
(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2:
①根据单质铁除砷原理,请解释水样酸性较强时,除砷效率较低的原因可能是酸性较强时,单质铁被腐蚀后,无法生成水合氧化铁,吸附能力下降,除砷效率降低;
②国家饮用水标准规定水中砷的含量应低于0.05mg/L(1mg=1000μg),根据图中信息判断:若控制水样的pH=6,出水后的砷浓度是否达到饮用水标准?达到.(填
“达到”、“未达到”或“无法判断”)
(4)为验证假设3,课题组成员设计了以下实验.请你完成表格中的内容(水样中砷的浓度可用分光光度计测定)
| 实验步骤 | 预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧; | 若溶解氧不同的两份溶液中,测出的砷的浓度不同,则溶解氧对砷的去除效率有影响;反之则无影响. |
| ②向上述两份溶液中投入足量等质量的同种单质铁 | |
| ③相同一段时间后,用分光光度计测定两份水样中砷的浓度 |