题目内容
下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、1mol甲基的电子数目为9NA |
| C、标准状况下,2.24L Cl2溶于水中达到饱和,转移的电子数是0.1NA |
| D、2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算NA个Fe(OH)3胶体粒子的质量;
B.甲基中含有9个电子,1mol甲基中含有9mol电子;
C.标况下2.24L氯气的物质的量为0.1mol,0.1mol氯气溶于水,只有部分氯气与反应生成氯化氢和次氯酸;
D.钠为1价金属,2.3g钠的物质的量为10.1mol,完全反应0.1mol钠会失去0.1mol电子.
B.甲基中含有9个电子,1mol甲基中含有9mol电子;
C.标况下2.24L氯气的物质的量为0.1mol,0.1mol氯气溶于水,只有部分氯气与反应生成氯化氢和次氯酸;
D.钠为1价金属,2.3g钠的物质的量为10.1mol,完全反应0.1mol钠会失去0.1mol电子.
解答:
解:A.氢氧化铁胶体中的胶粒为氢氧化铁的聚集体,无法计算胶体中含有胶粒的质量,故A错误;
B.1mol甲基中含有9mol电子,含有的电子数目为9NA,故B正确;
C.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸,标况下2.24L氯气的物质的量为0.1mol,完全反应转移的电子小于0.1mol,转移的电子数小于0.1NA,故C错误;
D.2.3g钠的物质的量为10.1mol,0.1mol钠完全反应会失去0.1mol电子,反应中转移的电子数为0.1NA,故D错误;
故选B.
B.1mol甲基中含有9mol电子,含有的电子数目为9NA,故B正确;
C.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸,标况下2.24L氯气的物质的量为0.1mol,完全反应转移的电子小于0.1mol,转移的电子数小于0.1NA,故C错误;
D.2.3g钠的物质的量为10.1mol,0.1mol钠完全反应会失去0.1mol电子,反应中转移的电子数为0.1NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;选项A为易错点,转移氢氧化铁胶粒为氢氧化铁的聚集体.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
下列反应的离子方程式书写不正确的是( )
| A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、碘化钾与适量溴水反应:2I-+Br2═I2+2Br- |
| C、硫化钾的水解:S2-+2H2O?H2S+2OH- |
| D、向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
下列醇不能在铜的催化下发生氧化反应的是( )
A、 |
| B、CH3CH2CH2OH |
C、 |
D、 |
正确表示下列反应的离子反应方程式为( )
A、NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3-+2OH-
| ||||
| B、Fe溶于足量稀硝酸:Fe+2H+﹦Fe2++H2↑ | ||||
| C、向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | ||||
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
以保护环境和垃圾资源化为目的,下列垃圾属于同类物质的是( )
| A、废铜烂铁、废塑料 |
| B、废电池、易拉罐 |
| C、废报纸、硬纸板 |
| D、塑料袋、空酒瓶 |
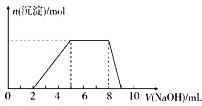 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、[Al(OH)4]-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、[Al(OH)4]-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比为1:3 |
| D、原溶液中含有的阴离子是[Al(OH)4]-、Cl- |
甲烷在光照条件下与氯气发生取代反应,理论上得到的有机产物最多有几种( )
| A、4种 | B、5种 | C、6种 | D、7种 |
 将锌棒和石墨棒按如图所示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )
将锌棒和石墨棒按如图所示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )| A、将电能转变为化学能 |
| B、电子由石墨棒流出 |
| C、锌为正极 |
| D、电池反应为:Zn+CuSO4═ZnSO4+Cu |
下列化合物中,既有离子键,又有共价键的是( )
| A、Na2O2 |
| B、NH3 |
| C、H2SO4 |
| D、MgCl2 |