题目内容
3.下列说法正确的是( )| A. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | 若物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,则在pH=7的NH4Cl和NH3•H2O混合溶液中:c(NH4+)>c(NH3•H2O) | |
| C. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3) | |
| D. | 0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
分析 A、pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量;
B、物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,说明NH3•H2O的电离程度大于NH4Cl的水解程度;
C、根据电荷守恒和物料守恒来分析;
D、根据电荷守恒分析.
解答 解:A、pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性,故A错误;
B、物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,说明NH3•H2O的电离程度大于NH4Cl的水解程度,故若使溶液的pH=7,则必须c(NH4Cl)>c(NH3•H2O),即c(NH4+)>c(NH3•H2O),故B正确;
C、根据电荷守恒可知:c(H+)+c(Na+)=2c(SO32-)+c(OH-)+c(HSO3-)
根据物料守恒可知:c(Na+)=c(SO32-)+c(H2SO3)+c(HSO3-)
两式把c(Na+)带入消去就得到c(H+)-c(OH-)=c(SO32-)-c(H2SO3),故C错误;
D、将0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等体积混合,即得到浓度均为0.005mol/LNa2CO3和NaHSO4的混合溶液,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),故D错误.
故选B.
点评 本题考查了盐溶液中的三个守恒的综合运用以及离子浓度的大小比较,应注意在掌握好基础的前提下对解题能力进行提升.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
13.将烧碱溶液和盐酸一次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是( )
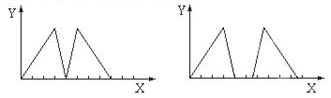

| A. | 三溴化铝溶液 | B. | 偏铝酸钠溶液 | C. | 明矾溶液 | D. | 硝酸铝溶液 |
14.某化合物的结构(键线式)及球棍模型如图1:该有机分子的核磁共振波谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
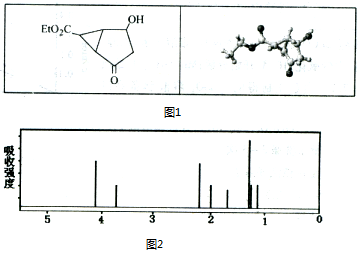

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生加成反应、取代反应,但不能发生消去反应 |
11.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是
( )
( )
| R | ||
| X | Y | Z |
| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸 | |
| C. | R、X、Y三者的气态氢化物稳定性依次增强 | |
| D. | Z的单质能与Y的某些化合物发生置换反应 |
18.某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)=2.5mol•L-1,取200mL该混合酸,则能溶解铜的最大质量为( )
| A. | 12.8 g | B. | 19.2 g | C. | 32.0 g | D. | 38.4 g |
4.下列对物质或离子的检验,结论正确的是( )
| A. | 加入KSCN溶液,溶液变红,证明原溶液含有Fe3+ | |
| B. | 将气体通入KMnO4酸性溶液,紫色褪色,证明气体为乙烯 | |
| C. | 将气体通入澄清石灰水,有白色沉淀,证明气体为CO2 | |
| D. | 加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42- |
5.阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A. | 在标准状况下,2.24L HF中所含有的分子数约为6.02×1022 | |
| B. | 3.2克的Cu与足量的浓硝酸反应生成的气体分子数约为6.02×1022 | |
| C. | 含有6.02×1023个中子的D2O的质量为2.0g | |
| D. | pH=2的硫酸氢钠溶液中的硫酸根离子数约为6.02×1021 |