题目内容
4.下列对物质或离子的检验,结论正确的是( )| A. | 加入KSCN溶液,溶液变红,证明原溶液含有Fe3+ | |
| B. | 将气体通入KMnO4酸性溶液,紫色褪色,证明气体为乙烯 | |
| C. | 将气体通入澄清石灰水,有白色沉淀,证明气体为CO2 | |
| D. | 加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42- |
分析 A.铁离子结合SCN-离子生成血红色溶液;
B.具有还原性的不一定为乙烯;
C.也可能为二氧化硫;
D.可能生成AgCl沉淀.
解答 解:A.溶液中加入KSCN溶液,铁离子结合SCN-离子生成血红色溶液,证明原溶液中含铁离子,故A正确;
B.将气体通入KMnO4酸性溶液,紫色褪色,说明气体具有还原性,但不一定为乙烯,也可能为二氧化硫等,故B错误;
C.二氧化硫、二氧化碳都可使澄清石灰水变浑浊,也可能为二氧化硫,故C错误;
D.可能生成AgCl沉淀,如检验硫酸根离子,应先加入盐酸,如无现象,再加入氯化钡,故D错误.
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的逻辑推理能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法不正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 油脂水解生成甘油和高级脂肪酸或高级脂肪酸盐 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 重油裂解可以得到汽油 |
3.下列说法正确的是( )
| A. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | 若物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,则在pH=7的NH4Cl和NH3•H2O混合溶液中:c(NH4+)>c(NH3•H2O) | |
| C. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3) | |
| D. | 0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
12.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为151kJ;
(3)Bodensteins研究了下列反应:2HI(g)═H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向正(填“正”或“逆”)反应方向移动,达到平衡后x(HI)不变(填“增大”、“减小”或“不变”).
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1min-1.
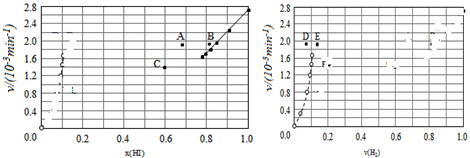
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).
(1)海带中富含碘,请简述检验碘的实验方案取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为151kJ;
(3)Bodensteins研究了下列反应:2HI(g)═H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向正(填“正”或“逆”)反应方向移动,达到平衡后x(HI)不变(填“增大”、“减小”或“不变”).
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1min-1.
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).

13.a g密度为d1 g/cm3质量分数为ω1的硝酸钾溶液,采取某种措施变成bg密度为d2g/cm3质量分数为ω2的硝酸钾饱和溶液,下列表达一定正确的是( )
| A. | a>b | B. | d1>d2 | C. | bω2≥aω1 | D. | a d1ω1=b d2ω2 |
14.下列实验方案正确且能达到相应实验预期目的是( )
| A. | 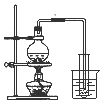 制取少量蒸馏水 | B. |  制取少量NO2 | ||
| C. | 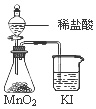 比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
 .
.



 反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.