题目内容
工业上用铝土矿(主要成分为Al203,还有少量的Fe203、Si02等杂质)提取氧化铝,操作过程如下:
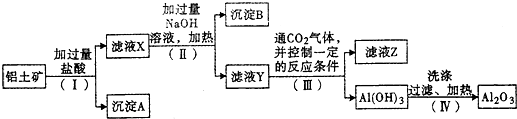
(1)沉淀A中主要含有
(2)滤液X中,除了Fe3+、H+外,还含有的阳离子是
(3)(Ⅱ)步骤中分离溶液和沉淀的操作名称是
(4)Al203属于 氧化物(填“酸性”或“碱性”或“两性”),写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式 .
(5)写出(Ⅳ)步骤反应的化学方程式 .

(1)沉淀A中主要含有
(2)滤液X中,除了Fe3+、H+外,还含有的阳离子是
(3)(Ⅱ)步骤中分离溶液和沉淀的操作名称是
(4)Al203属于
(5)写出(Ⅳ)步骤反应的化学方程式
考点:镁、铝的重要化合物,物质的分离、提纯和除杂
专题:实验题
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
铝土矿中加入盐酸,沉淀A为SiO2,滤液X中含有AlCl3、FeCl3,加入过量NaOH,沉淀B为Fe(OH)3,滤液Y中含有NaAlO2,通入二氧化碳气体,滤液Z中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,以此解答该题.
铝土矿中加入盐酸,沉淀A为SiO2,滤液X中含有AlCl3、FeCl3,加入过量NaOH,沉淀B为Fe(OH)3,滤液Y中含有NaAlO2,通入二氧化碳气体,滤液Z中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,以此解答该题.
解答:
解:铝土矿中加入盐酸,沉淀A为SiO2,滤液X中含有AlCl3、FeCl3,加入过量NaOH,沉淀B为Fe(OH)3,滤液Y中含有NaAlO2,通入二氧化碳气体,滤液Z中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,
(1)因SiO2与盐酸不反应,则沉淀A为SiO2,故答案为:SiO2;
(2)氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,滤液A中除了Fe3+、H+外,还含有的阳离子是Al3+,故答案为:Al3+;
(3)(Ⅱ)步骤中分离溶液和沉淀,应为过滤操作,故答案为:过滤;
(4)氧化铝为两性氧化物;滤液X中含有AlCl3、FeCl3,加入过量的氢氧化钠后发生反应:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,FeCl3+3NaOH=Fe(OH)3↓+3NaCl,(Ⅱ)步骤中生成Fe(OH)3的离子方程式为:Fe3++3OH-=Fe(OH)3↓,故答案为:两性;Fe3++3OH-=Fe(OH)3↓;
(5)氢氧化铝在加热分解可生成氧化铝,分解的方程式为:2Al(OH)3
Al203+3H2O,故答案为:2Al(OH)3
Al203+3H2O.
(1)因SiO2与盐酸不反应,则沉淀A为SiO2,故答案为:SiO2;
(2)氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,滤液A中除了Fe3+、H+外,还含有的阳离子是Al3+,故答案为:Al3+;
(3)(Ⅱ)步骤中分离溶液和沉淀,应为过滤操作,故答案为:过滤;
(4)氧化铝为两性氧化物;滤液X中含有AlCl3、FeCl3,加入过量的氢氧化钠后发生反应:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,FeCl3+3NaOH=Fe(OH)3↓+3NaCl,(Ⅱ)步骤中生成Fe(OH)3的离子方程式为:Fe3++3OH-=Fe(OH)3↓,故答案为:两性;Fe3++3OH-=Fe(OH)3↓;
(5)氢氧化铝在加热分解可生成氧化铝,分解的方程式为:2Al(OH)3
| ||
| ||
点评:本题以框图题形式考查铝的化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验方案合理的是( )
| A、用过滤的方法分离苯和苯酚 |
| B、用NaOH溶液除去乙酸乙酯中混有的乙酸等杂质 |
| C、制备氢氧化铁胶体时,将FeCl3饱和溶液逐滴滴入沸水中 |
| D、用湿润的红色石蕊试纸测量某溶液的酸碱性 |
HClO是比H2CO3还弱的酸,为了提高氯水中HClO的浓度,可加入( )
| A、HCl |
| B、CaCO3(s) |
| C、H2O |
| D、NaOH(s) |
加拿大阿尔贡天文台在星际间发现了HC9N链状分子,其结构式为:CH≡C-C≡C-C≡C-C≡C-C≡N,这是人类发现的最重星际有机分子,有关该分子的说法不正确的是( )
| A、该物质属于不饱和烃 |
| B、该分子碳、氮原子均满足8电子结构 |
| C、该分子所有原子处在一条直线上 |
| D、1mol该物质在一定条件下可与8molH2发生加成反应 |
实验室可用二氧化锰粉末与浓盐酸共热制取氯气.现只有浓盐酸,但没有二氧化锰,下列各种试剂中,不能替代二氧化锰制取氯气的是( )
| A、KMnO4 |
| B、KClO3 |
| C、CaCl2 |
| D、Ca(ClO)2 |