题目内容
 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:(1)电解食盐水时,总反应的离子方程式
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
(3)已知:
①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②Ti(s)+2Cl2(g)=TiCl4(g)△H=-770kJ?mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s)△H=
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
(5)已知2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1(a>0),在一有催化剂的固定容积容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol?L-1,放出热量b kJ.
①比较a
考点:电解原理,反应热和焓变,热化学方程式,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据电解饱和食盐水时,Cl-在阳极放电,H+在阴极放电;
(2)可按流程图找出反应物和生成物;
(3)根据盖斯定律,①×2-②可得;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,负极上的电极反应式等于电池的总反应式-正极发生的电极方程式;
(5)①反应是可逆反应不能进行彻底,焓变是指完全反应的能量变化;
②反应是放热反应,升温平衡逆向进行,平衡常数减小;
(2)可按流程图找出反应物和生成物;
(3)根据盖斯定律,①×2-②可得;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,负极上的电极反应式等于电池的总反应式-正极发生的电极方程式;
(5)①反应是可逆反应不能进行彻底,焓变是指完全反应的能量变化;
②反应是放热反应,升温平衡逆向进行,平衡常数减小;
解答:
解:(1)因电解饱和食盐水时,Cl-在阳极放电,H+在阴极放电,所以反应的离子方程式是:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑
(2)按流程图找出反应物和生成物,方程式为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO,故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(3)反应2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ?mol-1
故答案为:-512 kJ/mol;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,正极反应为:3O2+12H2O+12e-=12OH-,总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,两式相减,负极反应为:2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为:2CH3OH-12e-+16OH-=2CO32-+12H2O.
(5)①已知2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1(a>0),在一有催化剂的固定容积容器中加入2mol A2和1mol B2,反应达到平衡状态不能进行彻底,消耗A2的物质的量小于2mol,在500℃时充分反应达平衡后C3的浓度为w mol?L-1,放出热量b kJ,b<a;
故答案为:>;
②反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:减小;
| ||
故答案为:2Cl-+2H2O
| ||
(2)按流程图找出反应物和生成物,方程式为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO,故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(3)反应2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ?mol-1
故答案为:-512 kJ/mol;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,正极反应为:3O2+12H2O+12e-=12OH-,总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,两式相减,负极反应为:2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为:2CH3OH-12e-+16OH-=2CO32-+12H2O.
(5)①已知2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1(a>0),在一有催化剂的固定容积容器中加入2mol A2和1mol B2,反应达到平衡状态不能进行彻底,消耗A2的物质的量小于2mol,在500℃时充分反应达平衡后C3的浓度为w mol?L-1,放出热量b kJ,b<a;
故答案为:>;
②反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:减小;
点评:本题考查了电解原理、原电池原理的分析应用,热化学方程式书写,化学平衡常数影响因素、平衡移动原理是解题关键,将众多的知识融合于工业生产中,考查了学生分析问题解决问题的能力,题目难度中等.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列物质的水溶液能导电而本身不是电解质的是( )
| A、氨气 | B、硫酸 |
| C、氧化钠 | D、硫酸钠 |
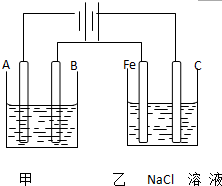 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: