题目内容
关于杂化轨道类型,下列判断错误的是( )
| A、苯中的C和SO2中的S都采取的是sp2杂化类型 |
| B、N2H4中的N和HClO中的O都采取的是sp3杂化类型 |
| C、乙烯发生加成反应时C原子杂化类型不会发生变化 |
| D、CS2和C2H2中的C都采取的是sp杂化类型 |
考点:原子轨道杂化方式及杂化类型判断
专题:
分析:根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型.
A.中心原子的杂化轨道类型属于sp2,说明其价层电子对个数是3,根据价层电子对互斥理论来分析解答;
B.分子或离子中,存在sp3杂化类型的原子含有4个价层电子对;
C.乙烯中C原子采用sp2杂化,加成后杂化方式为sp3杂化;
D.中心原子以sp杂化轨道成键,说明该分子中心原子的价层电子对为2.
A.中心原子的杂化轨道类型属于sp2,说明其价层电子对个数是3,根据价层电子对互斥理论来分析解答;
B.分子或离子中,存在sp3杂化类型的原子含有4个价层电子对;
C.乙烯中C原子采用sp2杂化,加成后杂化方式为sp3杂化;
D.中心原子以sp杂化轨道成键,说明该分子中心原子的价层电子对为2.
解答:
解:A.C6H6中的C含有3个σ 键且不含孤电子对,所以碳原子采用sp2杂化,SO2中的S原子价层电子对个数=2+
×(6-2×2)=3,S原子的杂化类型为sp2杂化,故A正确;
B.N2H4分子中N原子价层电子对个数=3+
×(5-3×1)=4,所以N原子采用sp3杂化,HClO中的O原子价层电子对个数=2+
×(6-1×2)=4,所以O原子采用sp3杂化,故B正确;
C.乙烯中C含有3个σ 键且不含孤电子对,所以碳原子采用sp2杂化,加成后碳碳双键变为碳碳单键,杂化方式为sp3杂化,故C错误;
D.CS2中的C含有2个σ 键和2个π键且不含孤电子对,C2H2中的C含有2个σ 键和2个π键且不含孤电子对,它们的C都采取的是sp杂化类型,故D正确;
故选C.
| 1 |
| 2 |
B.N2H4分子中N原子价层电子对个数=3+
| 1 |
| 2 |
| 1 |
| 2 |
C.乙烯中C含有3个σ 键且不含孤电子对,所以碳原子采用sp2杂化,加成后碳碳双键变为碳碳单键,杂化方式为sp3杂化,故C错误;
D.CS2中的C含有2个σ 键和2个π键且不含孤电子对,C2H2中的C含有2个σ 键和2个π键且不含孤电子对,它们的C都采取的是sp杂化类型,故D正确;
故选C.
点评:本题考查了分子或离子中原子轨道杂化类型的判断,注意价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,题目难度中等.
| 1 |
| 2 |

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
某学生在一带活塞的密闭容器中装入1molNaHCO3和1molNa2O2,加热充分反应后容器内残留的固体是( )
| A、0.8molNa2CO3和0.6molNaOH |
| B、1molNa2CO3和1molNaOH |
| C、0.8molNa2CO3和1molNaOH |
| D、1molNa2CO3和0.6molNaOH |
在给定的四种溶液中,同时加入以下各种离子,可能在该溶液中大量共存的是( )
| A、pH为1的溶液:Ca2+、Na+、Mg2+、NO3- |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| C、与铝反应放出氢气的溶液:K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为FeCl2的溶液:K+、SO42-、NO3-、H+ |
已知在标准状况下的四种气体 ①6.72L CH4;②3.01×1023个HCl分子;③13.6克H2S;④0.2molNH3该条件下体积最大和含氢原子数最多的依次是( )
| A、②和① | B、②和④ |
| C、①和④ | D、③和① |
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+2e-+H2O=2Ag+2OH-.椐此判断下列叙述中正确的是( )
| A、电池放电时,电池负极区溶液的碱性增强 |
| B、电池放电时,电子从Ag2O电极经外电路流向Zn电极 |
| C、Zn电极为负极,被氧化;Ag2O电极为正极,被还原 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
下列离子方程式中书写正确的是( )
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |
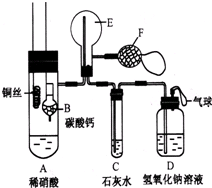 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答: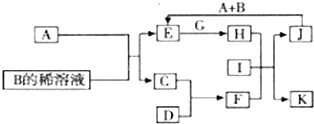 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.