题目内容
7.下列有关叙述中错误的是( )| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| C. | 原子的次外层电子数不一定是8个 | |
| D. | 一切原子的原子核都是由质子和中子构成 |
分析 A.随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化;
B.原子的核外电子总数=核电荷数=质子数,若核外电子排布相同,则质子数相同;
C.第二周期元素的次外层含有2个电子;
D.原子的原子核是由质子和质子构成的.
解答 解:A.由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,元素相对原子质量的递增不是决定因素,故A错误;
B.两个原子如果核外电子排布相同,则两个原子具有相同的质子数,一定是同一种元素,故B正确;
C.原子的次外层电子数不一定是8个,如第二周期元素的次外层为2个电子,故C正确;
D.所有原子的原子核都是由质子和中子构成的,故D正确;
故选A.
点评 本题考查了原子结构、元素周期律内容等知识,题目难度中等,明确原子结构与元素周期律的关系为解答关键,注意熟练掌握元素周期律内容、原子核外电子排布特点.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
17.等质量的两份铜,分别与足量的浓硝酸和稀硝酸完全反应,在相同条件下再用排水法收集反应产生的气体,下列叙述正确的是( )
| A. | 浓硝酸消耗的HNO3少,而稀硝酸消耗的多 | |
| B. | 两者生成的Cu(NO3)2的物质的量不相同 | |
| C. | 两者用排水法收集的气体体积相同 | |
| D. | 浓硝酸产生的NO2少,而稀硝酸产生的NO多 |
18.反应CO+H2O(g)?CO2+H2在1000℃达到平衡时,分别改变下列条件,化学平衡常数K值发生变化的是( )
| A. | 将压强减小至原来的一半 | B. | 将反应温度升高至1200℃ | ||
| C. | 添加催化剂 | D. | 增大水蒸气的浓度 |
15.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- | |
| B. | 滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl- | |
| C. | c(Fe2+)=1 mol•L-1的溶液:H+、Na+、Cl-、NO3- | |
| D. | 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3- |
12.下列说法正确的是( )
| A. | 同物质的量的N2和HCl的原子数相同,分子数也相同 | |
| B. | 0.05mol H2SO4含有氧原子数的精确值为1.024×1023 | |
| C. | 0.1mol氯的微粒数约为6.02×1023个 | |
| D. | 1mol NaClO含有阿伏加德罗常数个氯分子 |
19.下列叙述正确的是( )
| A. | Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 | |
| D. | 0.1mol•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
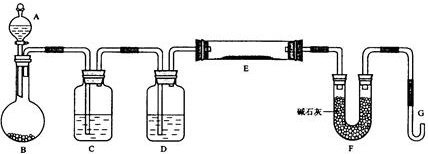
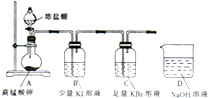 某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.
某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.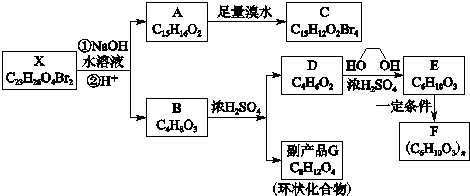
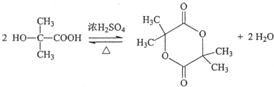 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式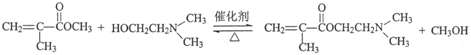 .
.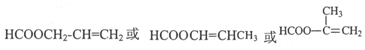 .
.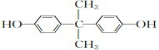 .
.