题目内容
下列说法不正确的是( )
| A、某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| B、某微粒空间构型为V形,则中心原子一定有孤电子对 |
| C、某微粒空间构型为三角锥形,则该微粒一定是极性分子 |
| D、某微粒空间构型为正四面体,则键角一定是109°28’ |
考点:原子轨道杂化方式及杂化类型判断,键能、键长、键角及其应用,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A.微粒中立体构型是平面三角形,说明中心原子价层电子对个数是3且不含孤电子对,中心原子采用sp2杂化说明中心原子中价层电子对个数是3;
B.VSEPR模型为四面体说明该微粒的价层电子对是4,价层电子对=σ 键电子对+中心原子上的孤电子对,空间构型为V形说明该微粒中含有2个孤电子对;
C.对于ABn型,价层电子对=σ 键电子对+中心原子上的孤电子对,n=4含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子;
D.分子的空间构型是正四面体,结构对称,但键角不一定是109°28’,也可能键角为60°.
B.VSEPR模型为四面体说明该微粒的价层电子对是4,价层电子对=σ 键电子对+中心原子上的孤电子对,空间构型为V形说明该微粒中含有2个孤电子对;
C.对于ABn型,价层电子对=σ 键电子对+中心原子上的孤电子对,n=4含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子;
D.分子的空间构型是正四面体,结构对称,但键角不一定是109°28’,也可能键角为60°.
解答:
解:A.价层电子对=σ 键电子对+中心原子上的孤电子对,微粒中立体构型是平面三角形,说明中心原子价层电子对个数是3且不含孤电子对,中心原子是以sp2杂化,如BCl3中价层电子对个数=3+
×(3-3×1)=3,立体构型是平面三角形,中心原子是以sp2杂化,故A正确;
B.对于ABn型,若中心原子A的价电子全部成键,n=2为直线形,n=3为平面三角形,n=4为正四面体;n=4若中心原子A有孤电子对,空间构型为V形,说明该微粒中含有2个孤电子对,如H2O中心原子O原子价层电子对为2+2=4,VSEPR模型为四面体,由于含有2对孤电子对,故为V型,故B正确;
C.微粒中立体构型是三角锥型,说明中心原子A的价电子n=4且含有一个孤电子对,分子结构不对称,为极性分子,如PH3分子中价层电子对数=3+
×(5-3×1)=4,且含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子,故C正确;
D.分子的空间构型是正四面体,所含中心原子应能形成4个δ键,且结构对称,中心原子所形成的共价键键长相等,但键角不一定是109°28’,如白磷是正四面体结构,且四个顶点上分别含有一个原子,所以其键角为60°,故D错误;
故选D.
| 1 |
| 2 |
B.对于ABn型,若中心原子A的价电子全部成键,n=2为直线形,n=3为平面三角形,n=4为正四面体;n=4若中心原子A有孤电子对,空间构型为V形,说明该微粒中含有2个孤电子对,如H2O中心原子O原子价层电子对为2+2=4,VSEPR模型为四面体,由于含有2对孤电子对,故为V型,故B正确;
C.微粒中立体构型是三角锥型,说明中心原子A的价电子n=4且含有一个孤电子对,分子结构不对称,为极性分子,如PH3分子中价层电子对数=3+
| 1 |
| 2 |
D.分子的空间构型是正四面体,所含中心原子应能形成4个δ键,且结构对称,中心原子所形成的共价键键长相等,但键角不一定是109°28’,如白磷是正四面体结构,且四个顶点上分别含有一个原子,所以其键角为60°,故D错误;
故选D.
点评:本题考查了判断分子或离子的空间构型,注意ABn型,若中心原子A的价电子全部成键,n=2为直线形,n=3为平面三角形,n=4为正四面体;若中心原子A有孤电子对,根据中心原子价层电子对判断VSEPR模型,结合孤电子对判断空间构型,题目难度中等.

练习册系列答案
相关题目
等物质的量的下列有机物,消耗氧气量最多的是( )
| A、乙酸 | B、乙醇 | C、丙醛 | D、丙烷 |
下列各组物质中,化学键类型不同的是( )
| A、NaCl和HCl |
| B、H2O和NH3 |
| C、CaF2和CsCl |
| D、KCl和Na2O |
下列物质的性质比较,正确的是( )
| A、酸性:H2SO4>HClO4>HBrO4 |
| B、碱性:NaOH>KOH>RbOH |
| C、非金属性:P>S>Cl |
| D、气态氢化物稳定性:HF>H2O>PH3 |
下列叙述正确的是( )
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C、1.0×10-3mol/L盐酸的Ph=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、相同温度下,1 mol?L-1氨水溶液与0.5 mol?L-1氨水溶液中,c(OH-)之比是2:1 |
下列物质中,属于烃的衍生物的是( )
①CH2═CH2 ②CH3CH2OH ③CH3-C≡C-CH3 ④CH3-CH2-C≡CH
⑤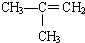 ⑥CaCO3 ⑦
⑥CaCO3 ⑦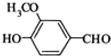 ⑧CH3CH2Br.
⑧CH3CH2Br.
①CH2═CH2 ②CH3CH2OH ③CH3-C≡C-CH3 ④CH3-CH2-C≡CH
⑤
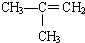 ⑥CaCO3 ⑦
⑥CaCO3 ⑦ ⑧CH3CH2Br.
⑧CH3CH2Br.| A、①③④⑤ | B、⑥⑦⑧ |
| C、②⑦⑧ | D、②⑧ |
下列关于碱金属的叙述正确的是( )
| A、碱金属元素与氧气反应均能形成过氧化物 |
| B、碱金属的密度随着原子序数的递增逐渐减小 |
| C、碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的递增依次增强 |
| D、碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |
下列操作或过程中,一定发生氧化还原反应的是( )
| A、蒸馏 | B、萃取 | C、燃烧 | D、爆炸 |