题目内容
3.已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下: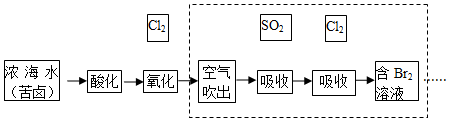
资料:溴单质容易挥发.
(1)写出“氧化”时的离子方程式2Br-+Cl2═2Cl-+Br2.
(2)写出第1步“吸收”时的离子方程式SO2+Br2+2H2O=4H++SO42-+2Br-,该反应体现了SO2的还原性.
(3)得到的“含Br2溶液”通过以下不同操作,都可得到溴单质:
①直接蒸馏得到溴单质,该操作利用的是溴的何种性质:沸点低,易挥发;
②加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质.可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:溴更易溶于有机溶剂.
(4)对虚线框中的流程进行整体分析,完整说明该流程中所有操作的目的是空气吹出是为了将溴单质从溶液中分离出来,同时增大了溴单质的浓度,用二氧化硫吸收是为了将溴元素进一步富集,用氯气吸收是为了将溴元素转化为最终目标物--溴单质.
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,完成下列化学反应方程式:Br2+Na2CO3=NaBrO3+CO2+3 Br2+3 Na2CO3=NaBrO3+3 CO2+5NaBr
若有480g溴完全反应,转移电子的物质的量为5 mol.
分析 海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,
(1)氯气具有氧化性能氧化溴离子生成单质溴;
(2)第1步“吸收”时的反应是二氧化硫和溴单质反应生成硫酸和溴化氢,反应中二氧化硫具有还原性;
(3)①溴单质沸点低易挥发;
②溴单质在四氯化碳中溶解度大;
(4)过程中得到溴单质,通过热空气吹出后用纯碱吸收得到溴酸根和溴离子,在酸溶液中重新得到溴单质是富集溴的过程;
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,发生反应生成溴化钠、溴酸钠、二氧化碳,结合原子守恒和电子守恒配平书写化学方程式.
解答 解:海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,
(1)“氧化”时的离子方程式为:2Br-+Cl2═2Cl-+Br2,
故答案为:2Br-+Cl2═2Cl-+Br2;
(2)第1步“吸收”时的反应是二氧化硫和溴单质反应生成硫酸和溴化氢,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-,反应中二氧化硫具有还原性
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;还原;
(3)①直接蒸馏得到溴单质,该操作利用的是溴的沸点低,易挥发,
故答案为:沸点低,易挥发;
②加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质.可以用四氯化碳对溴溶液进行萃取利用,利用的是溴单质在四氯化碳中溶解性大于水中溶解性,
故答案为:溴更易溶于有机溶剂;
(4)过程中得到溴单质,通过热空气吹出后用纯碱吸收得到溴酸根和溴离子,在酸溶液中重新得到溴单质,空气吹出是为了将溴单质从溶液中分离出来,同时增大了溴单质的浓度,用二氧化硫吸收是为了将溴元素进一步富集,用氯气吸收是为了将溴元素转化为最终目标物--溴单质,
故答案为:空气吹出是为了将溴单质从溶液中分离出来,同时增大了溴单质的浓度,用二氧化硫吸收是为了将溴元素进一步富集,用氯气吸收是为了将溴元素转化为最终目标物--溴单质;
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,发生反应生成溴化钠、溴酸钠、二氧化碳,结合原子守恒和电子守恒配平书写化学方程式为:3 Br2+3 Na2CO3=NaBrO3+3 CO2+5NaBr,反应中若有480g溴物质的量=$\frac{480g}{480g/mol}$=1mol,完全反应,转移电子的物质的量为5mol,
故答案为:3 Br2+3 Na2CO3=NaBrO3+3 CO2+5NaBr;5.
点评 本题考查了海水提溴的生产关系分析判断、过程中反应的原理和作用分析,主要是物质性质和氧化还原反应的理解应用,掌握基础是解题关键,题目难度中等.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 酸碱中和反应 | ||
| C. | 灼热的炭与CO2反应 | D. | H2与Cl2的燃烧反应 |
| A. | 1mol/L的Ca(C1O)2溶液中含C1O数目为2NA | |
| B. | 标准状况下,22.4L戊烷中的氢原子数约为12NA个 | |
| C. | 体积分别为1.0LpH=2的盐酸与硫酸溶液中氢离子数均为0.01NA | |
| D. | 1mol-OH与1molOH-所含电子数均为9NA |
| A. | 金刚石和C60 | B. | 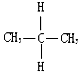 与 与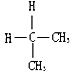 | ||
| C. | 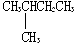 与 与 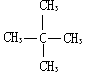 | D. | CH3CH3与CH3CH2CH2CH3 |
| A. | 它们都含有 92个中子 | B. | ${\;}_{92}^{235}$U原子核外有143个电子 | ||
| C. | 它们是同种核素 | D. | 它们互为同位素 |
| A. | 2-甲基-2,3-二氯戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,4,6-三氯己烷 | D. | 3-甲基-3-丁烯 |
| A. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne是同分异构体 | |
| B. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne属于不同的核素 | |
| C. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne的性质完全相同 | |
| D. | ${\;}_{10}^{22}$Ne转变为${\;}_{10}^{20}$Ne为化学变化 |

 .
.

 .
.