题目内容
5.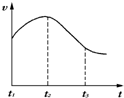 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含少量FeCl3的同浓度工业盐酸中,发现放出氢气量减少.
实验三、将不纯的锌片与盐酸反应,发现反应速率加快.
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快.
问题:
(A)试分析实验一中t1~t2速率变化的主要原因是因为反应放热,溶液温度升高,反应速率加快,t2~t3速率变化的主要原因是因为随反应进行,盐酸的浓度减小较大,反应速度减慢
(B)实验二放出氢气量减少的原因是(用所发生的离子反应的方程式表示)Zn+2Fe3+=2Fe2++Zn2+.
(C)某同学认为实验三和四反应速率加快原因是相同的,这个原因是均为原电池的存在
(D)在中学化学实验室的条件下,写出另外两种加快氢气生成的措施将锌片改为锌粉,加热,增大盐酸的浓度.
分析 (A)纯锌与稀盐酸反应,放出热量,速率加快,后期c(H+)起主导作用,随着反应进行c(H+)降低,反应速率减慢;
(B)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少;
(C)不纯的锌片以及含有铜的锌可形成原电池反应,加快反应速率;
(D)还可增大固体表面积、加热、增大浓度等,以加快反应速率.
解答 解:(A)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢;
故答案为:因为反应放热,溶液温度升高,反应速率加快;因为随反应进行,盐酸的浓度减小较大,反应速度减慢;
(B)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少,反应的离子方程式为Zn+2Fe3+=2Fe2++Zn2+,
故答案为:Zn+2Fe3+=2Fe2++Zn2+;
(C)不纯的锌片以及含有铜的锌可形成原电池反应,加快反应速率,故答案为:均为原电池的存在;
(D)还可增大固体表面积、加热、增大浓度等,以加快反应速率,故答案为:将锌片改为锌粉,加热,增大盐酸的浓度.
点评 本题考查学生对知识的迁移运用,涉及外界条件对反应速率的影响、原电池原理,为高频考点,侧重于学生的分析能力的考查,注意把握影响化学反应速率的因素,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列各溶液中的离子,因氧化还原反应而不能大量共存的是( )
| A. | Na+、HCO3-、K+、OH- | B. | Fe2+、H+、SO42-、NO3- | ||
| C. | Fe3+、SCN-、NH4+、Cl- | D. | AlO2-、OH-、Na+、NH4+ |
16.物质的量浓度相同的下列溶液中,符合按pH由小到大排列的是( )
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2S | |
| D. | NH4Cl (NH4)2SO4 Na2S NaNO3 |
13.下列4个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH2OH ④CH2=CHCH2OH⑤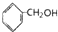
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH2OH ④CH2=CHCH2OH⑤

| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
20.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | H2与Cl2混合后点燃与 H2 在Cl2中安静燃烧的反应速率是一样大的 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
10.下列关于氨及铵盐的性质叙述中,正确的是( )
| A. | 氨气可用排水法收集 | |
| B. | 氯化铵固体加热容易分解 | |
| C. | 氨气和酸相遇都能产生白烟 | |
| D. | 实验室用氢氧化钠溶液和氯化铵溶液加热制NH3 |
17.下列推断正确的是( )
| A. | 常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
14.在2L密闭容器中,某气体反应物在2s内由8mol变为7.2mol,则用此反应物表示该反应的平均反应速率为( )
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
15.下列有关胶体的说法正确的是( )
| A. | 胶体比溶液更稳定 | |
| B. | 从外观一定能区别溶液和胶体 | |
| C. | 用渗析的方法净化胶体时,使用的半透膜只能让离子、小分子通过 | |
| D. | 淀粉溶液不是胶体 |