题目内容
某反应体系的物质有H2SO4、Cu2O、Fe2(SO4)3、CuSO4、FeSO4、H2O.
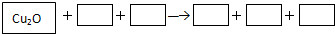
(1)请将Cu2O之外反应物与生成物分别填入以上空格内并配平.
(2)反应中,被还原的元素是 ,还原剂是 .
(3)每1molCu2O完全反应,转移的电子数目为 .

(1)请将Cu2O之外反应物与生成物分别填入以上空格内并配平.
(2)反应中,被还原的元素是
(3)每1molCu2O完全反应,转移的电子数目为
考点:氧化还原反应
专题:氧化还原反应专题
分析:由题给物质可知,Cu2O为反应物,反应生成CuSO4,Cu元素化合价由+1价升高到+2,被氧化,反应中元素化合价变化的还有Fe元素,则氧化剂应为Fe2(SO4)3,FeSO4为还原产物,结合元素化合价变化解答该题.
解答:
解:(1)由题给物质可知,Cu2O为反应物,反应生成CuSO4,Cu元素化合价由+1价升高到+2,被氧化,反应中元素化合价变化的还有Fe元素,则氧化剂应为Fe2(SO4)3,FeSO4为还原产物,Fe元素化合价由+3价降低到+2价,反应的方程式为Cu2O+Fe2(SO4)3+H2SO4═2CuSO4+2FeSO4+H2O,
故答案为:Fe2(SO4)3;H2SO4;2CuSO4;2FeSO4;H2O;
(2)Fe元素化合价由+3价降低到+2价,被还原,Cu元素化合价由+1价升高到+2价,为被氧化,Cu2O为还原剂,故答案为:Fe; Cu2O;
(3)Cu元素化合价由+1价升高到+2价,每1molCu2O完全反应,则失去2mol电子,个数为2NA或12.04×1023,故答案为:2NA或12.04×1023.
故答案为:Fe2(SO4)3;H2SO4;2CuSO4;2FeSO4;H2O;
(2)Fe元素化合价由+3价降低到+2价,被还原,Cu元素化合价由+1价升高到+2价,为被氧化,Cu2O为还原剂,故答案为:Fe; Cu2O;
(3)Cu元素化合价由+1价升高到+2价,每1molCu2O完全反应,则失去2mol电子,个数为2NA或12.04×1023,故答案为:2NA或12.04×1023.
点评:本题综合考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度解答该类题目,难度不大.

练习册系列答案
相关题目
下列物质中不属于糖类的化合物的是( )
| A、淀粉 | B、葡萄糖 |
| C、纤维素 | D、甲烷 |
水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、C(H+)随着温度升高而降低 |
| B、35℃时,c(H+)>c(OH-) |
| C、25℃时,PH=3的盐酸中由水电离产生的H+浓度为1.0×10-3mol?L-1 |
| D、35℃时,向溶液中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw不变 |
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 如图所示装置是实验室常用的一种制取气体的装置.
如图所示装置是实验室常用的一种制取气体的装置.