题目内容
1.石棉尾矿主要含有 Mg3(Si2O5)(OH)4 和少量的 Fe2O3、Al2O3.以石棉尾矿为镁源制备碳酸镁晶须(MgCO3•nH2O)的工艺如图1: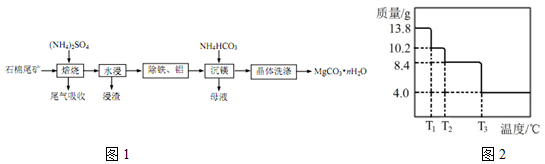
已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4$\frac{\underline{\;焙烧\;}}{\;}$3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑.
(1)写出焙烧产物 NH3 的电子式
 .
.(2)为提高水浸速率,可采取的措施为将焙烧渣粉碎或加热或搅拌(任写一条).“浸渣”的主要成分为SiO2.
(3)“除铁、铝”时,需将 pH 调至 8.0 左右,适宜作调节剂的是bc(填字母代号).
a.NaOHb.Mg(OH)2c.NH3•H2O
(4)“沉镁”过程中反应的离子方程式为Mg2++2HCO3-+(n-1)H2O=MgCO3•nH2O↓+CO2↑.“沉镁”时若温度超过 60℃,将产生较多的碱式碳酸镁杂质,原因是升温促进镁离子水解.
(5)流程中可以循环利用的物质是(NH4)2SO4(填化学式).
(6)某小组同学称取 13.8g MgCO3•nH2O 进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则 n=3.
分析 以石棉尾矿(主要含有Mg3 ( Si2O5) ( OH )4和少量的Fe2O3、Al2O3)为原料制备碳酸镁晶体(MgCO3•nH2O)的工艺流程:加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,形成Mg2+、Fe3+、Al3+的溶液,SiO2不溶于水形成浸渣,加入NH3•H2O将pH调至8.0左右,将Fe3+、Al3+以氢氧化物的形式过滤除去,向含有镁离子的滤液中加入碳酸氢铵发生反应:Mg2++2HCO3-+(n-1)H2O=MgCO3•nH2O↓+CO2↑,洗涤晶体可得,据此分析解答,
(1)氨气为共价化合物,氮原子和氢原子形成三个共价键;
(2)SiO2不溶于水形成浸渣;
(3)“除铁、铝”时,需将pH调至8.0左右,选择不引入新杂质的试剂;
(4)“沉镁”过程中反应生成碳酸镁晶体和二氧化碳;
(5)过程中参与反应,最后又生成的物质可以循环使用;“沉镁”时若温度超过 60℃,将产生较多的碱式碳酸镁杂质是没离子水解的原因;
(6)根据精确测定n的值,称取13.8gMgCO3•nH2O进行热重分析,图2所示的热重曲线示意图,MgCO2•nH2O受热分解生成MgO、CO2、H2O,最终剩余的固体为MgO4.0g,n(Mg)=$\frac{4.0g}{40g/mol}$=0.1mol,
则n(MgCO3)=n(Mg)=0.1mol,
m(MgCO3)=8.4g,
m(H2O)=13.8g-8.4g=5.4g,
n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,
1:n=n(MgCO3):n(H2O)计算得到.
解答 解:以石棉尾矿(主要含有Mg3 ( Si2O5) ( OH )4和少量的Fe2O3、Al2O3)为原料制备碳酸镁晶体(MgCO3•nH2O)的工艺流程:加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,形成Mg2+、Fe3+、Al3+的溶液,SiO2不溶于水形成浸渣,加入NH3•H2O将pH调至8.0左右,将Fe3+、Al3+以氢氧化物的形式过滤除去,向含有镁离子的滤液中加入碳酸氢铵发生反应:Mg2++2HCO3-+(n-1)H2O=MgCO3•nH2O↓+CO2↑,洗涤晶体可得,
(1)氨气为共价化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,SiO2不溶于水形成浸渣;
故答案为:将焙烧渣粉碎或加热或搅拌;SiO2;
(3)“除铁、铝”时,需将pH调至8.0左右,选择不引入新杂质的试剂,A会引入钠离子,不选,故可选用Mg(OH)2,NH3•H2O,
故答案为:bc;
(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3•nH2O↓+CO2↑,“沉镁”时若温度超过 60℃,将产生较多的碱式碳酸镁杂质,原因是升温促进镁离子水解,
故答案为:Mg2++2HCO3-+(n-1)H2O=MgCO3•nH2O↓+CO2↑;升温促进镁离子水解;
(5)沉镁过程的滤液为(NH4)2SO4,可循环使用;
故答案为:(NH4)2SO4;
(6)根据精确测定n的值,称取13.8gMgCO3•nH2O进行热重分析,图2所示的热重曲线示意图,MgCO2•nH2O受热分解生成MgO、CO2、H2O,最终剩余的固体为MgO4.0g,n(Mg)=$\frac{4.0g}{40g/mol}$=0.1mol,
则n(MgCO3)=n(Mg)=0.1mol,
m(MgCO3)=8.4g,
m(H2O)=13.8g-8.4g=5.4g,
n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,
1:n=n(MgCO3):n(H2O)=0.1:0.3,
故n=3,则该晶体化学式为MgCO3•3H2O,
故答案为:3.
点评 本题考查物质的制备和物质成分的探究,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| A. | 35Cl和37Cl-质子数、中子数均不相同 | |
| B. |  的名称为2,2-甲基丙烷 的名称为2,2-甲基丙烷 | |
| C. | H2O与D2O互为同素异形体 | |
| D. | (CH3)2CHCH2CH(CH3)2分子中一个氢原子被氯原子取代后的结构有3种 |
| A. | 用水鉴别乙醇、苯和溴苯 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、已烯、己烷 | |
| C. | 用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用燃烧法鉴别乙醇、苯和四氯化碳 |
| A. | 羽绒被 | B. | 有机玻璃 | C. | 面巾纸 | D. | 涤纶布 |

下列说法不正确的是( )
| A. | X、Y、Z三种元素的原子半径,Z的原子半径最小 | |
| B. | X和Y的单质(已除去表面氧化膜且形状完全一样)分别与等浓度的稀硫酸反应时,前者反应明显比后者剧烈 | |
| C. | 同分异构现象的广泛存在是含N的化合物种类繁多的原因之一 | |
| D. | M的氢化物的酸性比Z的氢化物强,因此M的气态氢化物比较稳定 |
| A. | SO2的反应速率和SO3的生成速率相等 | |
| B. | SO2的物质的量等于SO3的物质的量 | |
| C. | SO2的物质的量不再变化 | |
| D. | SO2的百分含量是O2百分含量的2倍 |
 .②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
.②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.