题目内容
明矾[KAl(SO4)2?12H2O]中S元素的化合价是( )
| A、-2 | B、+2 | C、+4 | D、+6 |
考点:根据化学式判断化合价
专题:氧化还原反应专题
分析:根据在化合物中正负化合价代数和为零进行计算明矾中S元素化合价.
解答:
解:根据在化合物中正负化合价代数和为零,钾的化合价为+1价,铝为+3价,氧为-2价,则明矾中S元素化合价为x:(+1)+(+3)+[x+(-2)×4]×2=0,
可得x=+6,故选D.
可得x=+6,故选D.
点评:本题主要考查根据物质的化学式分析物质的元素组成和元素化合价的计算的解题能力.

练习册系列答案
相关题目
钾的金属活动性比钠强,根本原因是( )
| A、钾的密度比钠的小 |
| B、钾原子的电子层比钠原子多一层 |
| C、钾与水反应比钠与水反应更剧烈 |
| D、加热时,钾比钠更易汽化 |
某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A、不能使酸性KMnO4溶液褪色 |
| B、不能使溴水褪色 |
| C、在加热和催化剂作用下,最多能和4mol H2反应 |
| D、一定条件下,能和NaOH醇溶液反应 |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、1mol聚乙烯含有的原子数目为6NA |
| B、标准状况下,11.2L二氯甲烷所含分子数为0.5NA |
| C、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| D、1mol甲基含10NA个电子 |
根据已知条件,对物质的性质强弱判断不正确的是( )
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
| C、已知NaClO+SO2+H2O→HClO+Na2SO3,说明给出质子能力:HSO3->HClO | ||||
D、已知CaCO3+SiO2
|
分子式为C6H14的烷烃有5种,其中一种有4个甲基且一氯代物只有2种烷烃A,A的二氯代物有( )
| A、5种 | B、6种 | C、7种 | D、8种 |
T℃时,CaCO3和CaF2的Ksp分别为1.0×10-12和4.0×10.下列说法正确的是( )
| A、T℃时,两饱和溶液中c(Ca2+):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
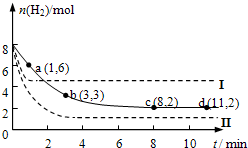 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q(Q>0)某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q(Q>0)某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题: