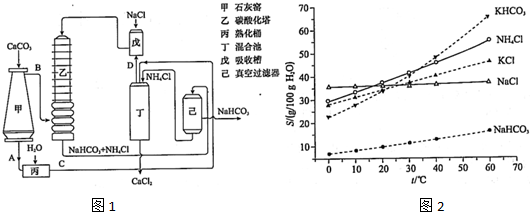
题目内容
已知有热化学方程式:SO2(g)+
O2(g)═SO3(g)△H=-98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于( )
| 1 |
| 2 |
| A、40% | B、50% |
| C、70% | D、80% |
考点:化学平衡的计算
专题:
分析:由SO2(g)+
O2(g)═SO3(g)△H=-98.32kJ/mol,得1molSO2完全反应,放出98.2kJ的热量,利用物质的量与放出的热量成正比计算反应的二氧化硫,以此计算SO2的转化率.
| 1 |
| 2 |
解答:
解:设反应的二氧化硫为x,则
SO2(g)+
O2(g)═SO3(g)△H=-98.32kJ/mol,
1mol 98.32kJ
x 314.3kJ
=
,解得x=3.196mol,
所以SO2的转化率为
×100%≈80%,
故选D.
SO2(g)+
| 1 |
| 2 |
1mol 98.32kJ
x 314.3kJ
| 1 |
| x |
| 98.32 |
| 314.3 |
所以SO2的转化率为
| 3.196 |
| 4 |
故选D.
点评:本题考查热化学反应方程式的计算,明确热化学方程式的意义及物质的量与热量的关系即可解答,题目难度不大.

练习册系列答案
相关题目
国际巴黎车展示上,世界各大汽车商纷纷推出环保动力小汽车,使用的新型环保电池为( )
| A、氢氧燃料电池 | B、锌锰电池 |
| C、镍镉电池 | D、铅蓄电池 |
下列分子式只能表示一种物质的是( )
| A、C3H6Cl2 |
| B、C3H8 |
| C、C2H6O |
| D、C8H10 |