题目内容
15.以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3.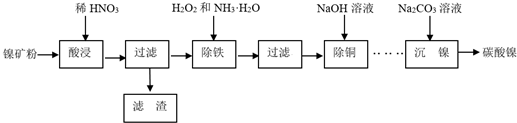
已知:Ni和Fe为变价金属,常见化合价为+2价、+3价.
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O+3S↓,滤渣的主要成分为S和SiO2.
(2)在除Fe时,需加入过量的H2O2 氧化.若用过强的氧化剂,其可能的后果是NiCO3中可能混有Ni2(CO3)3.反应完全后,除去多余H2O2 的简便方法是煮沸.
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入到盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是CO32-+H2O?HCO3-+OH-,Ni2++2OH-=Ni(OH)2↓.(用离子方程式表示)检验碳酸镍沉淀完全的方法是静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全.
分析 镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等),加硝酸酸浸,过滤,滤渣1为二氧化硅,浸出液含有Ni2+、Fe3+、Cu2+,加H2O2和NH3•H2O调节PH值产生氢氧化铁沉淀,过滤后向滤液中加氢氧化钠产生氢氧化铜沉淀,同时Ni2+不能转化为沉淀,过滤,滤液中含有Ni2+,滤液中加碳酸钠生成NiCO3沉淀.
(1)酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,该淡黄色固体为S,稀硝酸被还原为一氧化氮,据此写出离子方程式;二氧化硅不溶于酸,则滤渣体还有SiO2;
(2)最终产品是碳酸镍,镍的化合价为+2价,若在除Fe时,用过强的氧化剂,二价镍离子会被氧化成三价,最终NiCO3中可能混有Ni2(CO3)3,利用双氧水受热不稳定的性质可用煮沸的方法除去;
(3)Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,若将含Ni2+溶液缓慢加入到盛有Na2CO3溶液的反应容器中,会发生反应Ni2++2OH-=Ni(OH)2↓,
使产品不纯;检验碳酸镍沉淀完全的方法是静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全.
解答 解:镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等),加硝酸酸浸,过滤,滤渣1为二氧化硅,浸出液含有Ni2+、Fe3+、Cu2+,加H2O2和NH3•H2O调节PH值产生氢氧化铁沉淀,过滤后向滤液中加氢氧化钠产生氢氧化铜沉淀,同时Ni2+不能转化为沉淀,过滤,滤液中含有Ni2+,滤液中加碳酸钠生成NiCO3沉淀.
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,该淡黄色固体为S,稀硝酸被还原为一氧化氮,离子方程式为:3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O+3S↓,二氧化硅不溶于酸,则滤渣是淡黄色固体S和SiO2,
故答案为:3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O+3S↓;S和SiO2;
(2)最终产品是碳酸镍,镍的化合价为+2价,若在除Fe时,用过强的氧化剂,二价镍离子会被氧化成三价,最终NiCO3中可能混有Ni2(CO3)3,利用双氧水受热不稳定的性质可用煮沸的方法除去,
故答案为:NiCO3中可能混有Ni2(CO3)3;煮沸;
(3)Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,若将含Ni2+溶液缓慢加入到盛有Na2CO3溶液的反应容器中,会有反应:Ni2++2OH-=Ni(OH)2↓,
使产品不纯;检验碳酸镍沉淀完全的方法是静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全,
故答案为:CO32-+H2O?HCO3-+OH-,Ni2++2OH-=Ni(OH)2↓;静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全.
点评 本题考查了物质分离提纯基本操作和综合应用,题目难度中等,侧重于考查学生的分析能力和应用能力,注意把握常见物质或离子的分离提纯方法,特别注意题中所给信息的灵活处理.

| A. | 3种 | B. | 5种 | C. | 6种 | D. | 10种 |
 自然界中金属硫化物之间存在原电池反应,下图所示装置中电极I为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转.若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀.下列有关说法中正确的是( )
自然界中金属硫化物之间存在原电池反应,下图所示装置中电极I为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转.若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀.下列有关说法中正确的是( )| A. | 工业上利用该原理富集铁 | |
| B. | 电极Ⅱ作正极 | |
| C. | 溶液流经该装置后pH增大 | |
| D. | 该装置负极的电极反应为FeS2-15e-+8H2O=Fe3++2SO42-+16H+ |
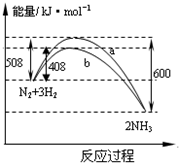
下列叙述正确的是( )
| A. | 该反应的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 曲线b表明加入催化剂降低了反应热,加快了反应速率 | |
| C. | 加入催化剂,生成1molNH3的反应热减小50KJ | |
| D. | 不用催化剂,生成1molNH3放出的热量为46KJ |

| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用氢氧化钠溶液吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤 |
| A. | 煤的干馏是化学变化 | |
| B. | 煤液化后可以得到甲醇等液体燃料 | |
| C. | 煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 | |
| D. | 从萃取分液后溴的四氯化碳溶液中提取溴可以用蒸馏的方法 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | 二氧化碳的结构式:O-C-O | B. | 过氧化钠的电子式: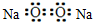 | ||
| C. | 丙烷分子的球棍模型: | D. | Cl-的结构示意图: |
 图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.
图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.