题目内容
已知,6.5g某气态烃在标准状况下的体积是5.6L.
(1)求该烃的摩尔质量.
(2)写出该烃的结构简式.
(3)若6.5g该烃被过量溴水完全吸收,反应中消耗的Br2是多少克?
(1)求该烃的摩尔质量.
(2)写出该烃的结构简式.
(3)若6.5g该烃被过量溴水完全吸收,反应中消耗的Br2是多少克?
考点:有关有机物分子式确定的计算
专题:有机物分子组成通式的应用规律
分析:(1)根据n=
计算出烃的物质的量,再根据M=
计算出该烃的摩尔质量;
(2)设烃的分子式为CxHy,根据12x+y=26进行讨论确定分子式,然后确定其结构简式;
(3)该烃为炔烃,1mol炔烃消耗2mol溴,据此计算出0.25mol该有机物消耗溴的物质的量、质量.
| V |
| 22.4L/mol |
| m |
| n |
(2)设烃的分子式为CxHy,根据12x+y=26进行讨论确定分子式,然后确定其结构简式;
(3)该烃为炔烃,1mol炔烃消耗2mol溴,据此计算出0.25mol该有机物消耗溴的物质的量、质量.
解答:
解:(1)标况下5.6L该烃的物质的量为:n=
=0.25mol,
该烃的摩尔质量为:M=
=26g/mol,
答:该烃的摩尔质量为26g/mol;
(2)设烃的分子式为CxHy,固体的相对分子量为26,则:12x+y=26,
(舍弃)、
(合理),则该有机物分子式为:C2H2,
所以该烃一定为乙炔,结构简式为:CH≡CH,
答:该烃的结构简式为CH≡CH;
(3)根据(1)可知,6.5g乙炔的物质的量为0.25mol,1mol乙炔中含有1mol碳碳三键,与溴发生加成反应消耗2mol溴单质,则0.25mol乙炔完全反应消耗溴的物质的量为:0.25mol×2=0.5mol,
消耗溴的质量为:160g/mol×0.5mol=80g,
答:6.5g乙炔完全反应消耗溴的质量为80g.
| 5.6L |
| 22.4L/mol |
该烃的摩尔质量为:M=
| 6.5g |
| 0.25mol |
答:该烃的摩尔质量为26g/mol;
(2)设烃的分子式为CxHy,固体的相对分子量为26,则:12x+y=26,
|
|
所以该烃一定为乙炔,结构简式为:CH≡CH,
答:该烃的结构简式为CH≡CH;
(3)根据(1)可知,6.5g乙炔的物质的量为0.25mol,1mol乙炔中含有1mol碳碳三键,与溴发生加成反应消耗2mol溴单质,则0.25mol乙炔完全反应消耗溴的物质的量为:0.25mol×2=0.5mol,
消耗溴的质量为:160g/mol×0.5mol=80g,
答:6.5g乙炔完全反应消耗溴的质量为80g.
点评:本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物分子式的计算方法,明确常见有机物结构与性质,试题培养了学生的分析、理解能力及化学计算的能力.

练习册系列答案
相关题目
100mL 1mol?L-1的AlCl3溶液中,逐渐滴入2mol?L-1 NaOH溶液,得到3.12g沉淀,则加入的NaOH溶液的体积是( )
①180mL ②200mL ③60mL ④120mL.
①180mL ②200mL ③60mL ④120mL.
| A、①② | B、②③ | C、①③ | D、③④ |
下列各物质中所含的少量杂质,用括号内的物质能除去,并且不引进其他杂质的是 ( )
| A、二氧化碳中所含的氯化氢(NaOH溶液) |
| B、氢气中所含的硫化氢(硫酸铜溶液) |
| C、乙酸乙酯中所含的乙酸(乙醇) |
| D、氯化钠溶液中所含的氯化钡(硫酸) |
已知一定条件下,N2(g)和H2(g)反应生成2mol NH3(g)放出92.4kJ热量.在此条件下,向甲、乙两个容器中分别通入1mol N2和4mol H2,开始时甲、乙两容器的体积相同,若甲容器保持体积不变,乙容器保持压强不变,达到平衡后分别放出热量Q1kJ和Q2kJ,则下列关系正确的是( )
| A、Q1=Q2=92.4 |
| B、Q1=Q2<92.4 |
| C、Q1<Q2<92.4 |
| D、Q2<Q1<92.4 |
下列物质的分离或鉴别正确的是( )
| A、除去混在氯化钠固体中的氯化铵或单质碘,均可用升华的方法 |
| B、若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液 |
| C、CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
| D、鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水 |
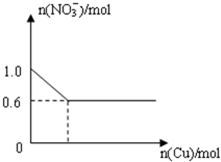 将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: