题目内容
18.H2S燃料电池应用前景非常广阔,该电池示意图如下.下列说法正确的是( )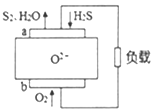
| A. | 电极a是正极 | |
| B. | O2-由电极a移向电极b | |
| C. | 电极 a 的反应式为:2H2S+2O2--4e-═S2+2H2O | |
| D. | 当通入1.12LO2,转移电子数0.2NA |
分析 在燃料电池中,燃料通入负极,氧气通入正极,则电极a是负极,电极b正极,正极O2得电子发生还原反应生成O2-,O2-移向负极,负极燃料H2S失电子发生氧化反应与O2-结合生成S2和H2O,据此分析解答.
解答 解:A.在燃料电池中通入燃料的一极为负极,则电极a为负极,故A错误;
B.原电池中阴离子向负极移动,正极b产生的O2-由电极b移向电极a,故B错误;
C.负极a是H2S失电子发生氧化反应,电极反应式为2H2S+2O2--4e-═S2+2H2O,故C正确;
D.正极电极反应为O2+4e-=2O2-,消耗1molO2,转移4mol电子,但题中没有指明标况,不能计算氧气的物质的量,故D错误;
故选C.
点评 本题考查了原电池的工作原理,涉及电极判断、电极方程式书写等相关知识,为高频考点,侧重于基础知识的考查,注意把握原电池的工作原理,题目难度不大.

练习册系列答案
相关题目
8.下列解释事实的方程式不正确的是( )
| A. | 焊接铁轨:2Fe+Al2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Al+Fe2O3 | |
| B. | 工业固氮:N2+3H2 $?_{催化剂}^{高温、高压}$ 2NH3 | |
| C. | 用纯碱除油污:CO32-+H2O?HCO3-+OH- | |
| D. | 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-═2Cl-+I2 |
13.下列有关化学与生产、生活的说法中,正确的是( )
| A. | 碳纤维、合成纤维和光导纤维都是无机非金属材料 | |
| B. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| C. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 | |
| D. | 铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝 |
3.零族元素难以形成化合物的根本原因是它们( )
| A. | 都是惰性元素 | B. | 化学性质不活泼 | ||
| C. | 都以单原子分子形式存在 | D. | 原子结构均为稳定结构 |
10.已知X+Y→M+N反应中的能量变化过程如图,则下列推断一定正确的是( )

| A. | X的能量低于M的能量 | |
| B. | Y的能量低于N的能量 | |
| C. | X和Y总能量低于M和N总能量 | |
| D. | 该反应是吸热反应,反应条件是加热 |
8.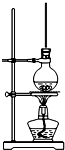 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
(1)写出该反应的化学方程式C2H5OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
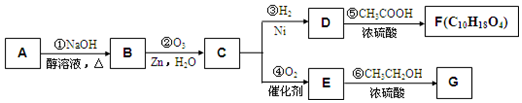
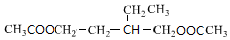 ,E
,E .
.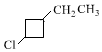 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$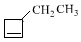 +NaBr+H2O,C→D
+NaBr+H2O,C→D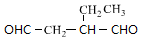 +2H2$\stackrel{催化剂}{→}$
+2H2$\stackrel{催化剂}{→}$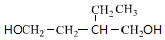 .
.