题目内容
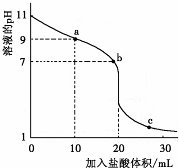 室温下,将0.1000mol?L-1盐酸滴入20.00mL 0.1000mol?L-1的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL 0.1000mol?L-1的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、该一元碱的电离方程式为MOH=M++OH- |
| B、a、b、c三点中,c点水的电离程度最小 |
| C、室温下,MOH的电离常数Kb=1×10-5 |
| D、b点:c(M+)+c(MOH)=c(Cl-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据图象知,没有滴入盐酸时,溶液的pH=11,而MOH的浓度为0.1000mol?L-1,MOH溶液中部分电离;
B.酸、碱溶液抑制了水的电离,溶液中氢离子或氢氧根离子浓度越大,则水的电离程度越小,c点无法满意告诉溶液pH,判断水的电离程度;
C.结合题中数据,根据MOH的电离常数的表达式Kb=
进行计算;
D.b点溶液的pH=7,溶液显示中性,根据混合液中的电荷守恒判断.
B.酸、碱溶液抑制了水的电离,溶液中氢离子或氢氧根离子浓度越大,则水的电离程度越小,c点无法满意告诉溶液pH,判断水的电离程度;
C.结合题中数据,根据MOH的电离常数的表达式Kb=
| c(M+)c(OH-) |
| c(MOH) |
D.b点溶液的pH=7,溶液显示中性,根据混合液中的电荷守恒判断.
解答:
解:A.根据图象知,0.1000mol?L-1的MOH溶液的pH=11,溶液中氢氧根离子浓度为0.001mol/L,说明MOH为弱电解质,所以其电离方程式为:MOH?M++OH-,故A错误;
B.图象中没有告诉c点溶液的pH或水溶液体积,无法判断c点水的电离程度大小,故B错误;
C.根据图象知,0.1000mol/LMOH溶液中pH=11,则c(OH-)=0.001mol/L,常温下,MOH的电离常数Kb=
=
=1×10-5,故C正确;
D.b点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒c(M+)+c(H+)=c(OH-)+c(Cl-)可得:c(M+)=c(Cl-),则c(M+)+c(MOH)>c(Cl-)故D错误;
故选C.
B.图象中没有告诉c点溶液的pH或水溶液体积,无法判断c点水的电离程度大小,故B错误;
C.根据图象知,0.1000mol/LMOH溶液中pH=11,则c(OH-)=0.001mol/L,常温下,MOH的电离常数Kb=
| c(M+)c(OH-) |
| c(MOH) |
| (0.001)2 |
| 0.1000 |
D.b点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒c(M+)+c(H+)=c(OH-)+c(Cl-)可得:c(M+)=c(Cl-),则c(M+)+c(MOH)>c(Cl-)故D错误;
故选C.
点评:本题考查了酸碱混合溶液定性判断,题目难度中等,明确图象中各个点的含义是解本题关键,结合电荷守恒来分析解答,注意水的电离程度与溶液酸碱性的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业品盐酸中因含有Fe3+而带黄色,若某工业品盐酸中的H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为( )
| A、1:1 | B、1:3 |
| C、91:94 | D、1:94 |
等质量的下列物质,所含分子数最多的是( )
| A、KCl |
| B、CH3COOH |
| C、SiO2 |
| D、P4 |
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡,测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B、和C,下列判断中正确的是( )
| A、平衡不移动 |
| B、平衡向正反应方向移动 |
| C、新平衡时各物质的浓度都比原平衡时增大 |
| D、C的质量分数减小 |
0.1mol KClO3和0.1mol KCl中,含有相等微粒个数的是( )
| A、氯原子 | B、氯离子 |
| C、钾原子 | D、钾离子 |
分子为C10H14的分子中含有苯环,且苯环上只有一个取代基,其可能的结构有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
有Xn+、Ym+、Zq-3种短周期元素的离子,它们各自带有的电荷数q<n<m=3,Zp-的电子层数比Xn+、Ym+多1,且Zp-的核外电子数与Ar相同,比较X、Y、Z及其化合物,则下列说法不正确的是( )
| A、原子半径X>Y>Z |
| B、离子半径Z>X>Y |
| C、Y(OH)m是一种弱碱性物质 |
| D、单质X常温下可与冷水反应 |
下列有关化学用语正确的是( )
A、甲烷分子的球棍模型 |
B、NH4I的电子式 |
C、F的原子结构示意图 |
D、苯酚的电离方程式: +H2O? +H2O? +H3O+ +H3O+ |