题目内容
3.现有原子序数小于20的A、B、C、D、E、F 6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的$\frac{1}{2}$;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:(1)用电子式表示A和E形成化合物的过程
 .
.(2)写出F原子的核外电子排布式1s22s22p63s23p64s1.
(3)写出A2D的电子式
 ,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
分析 原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B元素是地壳中含量最高的元素,则B为O元素;B和D元素的价电子数也相同,则D为S元素;A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的 $\frac{1}{2}$,则A、C的两原子的核外电子数之和为(8+16)×$\frac{1}{2}$=12,且A和C元素的价电子数相同,则A为H元素、C为Na元素;C、D、E三种元素的基态原子具有相同的能层数,且E原子的p能级上比D原子的p能级上多一个电子,则E为Cl元素;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族,处于第四周期,为K元素,据此进行解答.
解答 解:原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B元素是地壳中含量最高的元素,则B为O元素;B和D元素的价电子数也相同,则D为S元素;A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的 $\frac{1}{2}$,则A、C的两原子的核外电子数之和为(8+16)×$\frac{1}{2}$=12,且A和C元素的价电子数相同,则A为H元素、C为Na元素;C、D、E三种元素的基态原子具有相同的能层数,且E原子的p能级上比D原子的p能级上多一个电子,则E为Cl元素;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族,处于第四周期,为K元素,
(1)A为H、E为Cl元素,二者形成的化合物为HCl,HCl为共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为: ,
,
故答案为: ;
;
(2)F为K元素,原子核外有19个电子,K原子的核外电子排布式:1s22s22p63s23p64s1,
故答案为:1s22s22p63s23p64s1;
(3)A2D为H2S,硫化氢为共价化合物,其电子式为 ,其分子中含有两个H-S,不存在π键,
,其分子中含有两个H-S,不存在π键,
故答案为: ;含;不含.
;含;不含.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析能力及灵活应用能力.

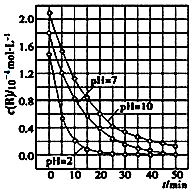 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )| A. | 在0~50 min之间,R的降解百分率pH=2大于pH=7 | |
| B. | 溶液酸性越强,R的降解速率越大 | |
| C. | R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 | |
| D. | 在20~25 min之间,pH=10时R的降解速率为04mol•L-1•min-1 |
| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
| A. | 常温常压下,1.7g NH3所含的电子数为0.8NA | |
| B. | 标准状况下,11.2L SO2所含的氧原子数为1.5NA | |
| C. | 1mol Fe与足量的稀硝酸反应,转移的电子总数为3NA | |
| D. | 0.1mol•L-1的Na2CO3溶液中含有的钠离子数为0.2NA |
| A. | 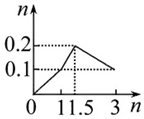 向1 L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L-1稀硫酸 | |
| B. |  向1 L含有0.1 mol•L-1 AlCl3和0.3 mol•L-1 NH4Cl的混合液中加入0.1 mol•L-1 NaOH溶液 | |
| C. |  向烧碱溶液滴加明矾溶液 | |
| D. | 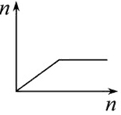 向AlCl3溶液滴加过量氨水 |
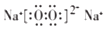 (用电子式表示).
(用电子式表示).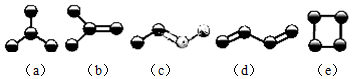
 .
.