题目内容
1.硫酸钠-过氧化氢加合物(xNa2SO4•yH2O2•zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100.00mL溶液A.
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.
③准确量取25.00mL溶液A,加适量稀硫酸酸化后,用0.02000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00mL.
H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
则x:z的比值为( )
| A. | 1 | B. | 2 | C. | 4 | D. | 0.5 |
分析 白色固体0.5825g为BaSO4,根据硫酸根守恒计算25mL溶液中n(Na2SO4),根据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,计算25mL溶液中n(H2O2),进而计算100mL溶液中Na2SO4、H2O2的物质的量,再根据样品质量计算结晶水的质量,进而计算结晶水的物质的量,可以确定x、z的比值.
解答 解:白色固体0.5825g为BaSO4,根据硫酸根守恒,25mL溶液中n(Na2SO4)=n(BaSO4)=$\frac{0.5825g}{233g/mol}$=0.0025mol,则100mL溶液中Na2SO4的物质的量为0.0025mol×$\frac{100mL}{25mL}$=0.01mol,
根据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,可知25mL溶液中n(H2O2)=$\frac{5}{2}$×0.02mol•L-1KMnO4×0.025L=0.00125mol,100mL溶液中H2O2的物质的量为0.00125mol×$\frac{100mL}{25mL}$=0.005mol,
则样品中结晶水的质量=1.77g-0.01mol×142g/mol-0.005mol×34g/mol=0.18g,则结晶水的物质的量为$\frac{0.18g}{18g/mol}$=0.01mol,
则x、z的比值为0.01mol:0.01mol=1,
故选:A.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
12.由两种原子组成的纯净物( )
| A. | 一定是化合物 | B. | 可能是单质,可能是化合物 | ||
| C. | 一定是单质 | D. | 一定是不同的单质 |
9.下列金属材料在使用过程中采取的防腐蚀措施错误的是( )
| A. | 自行车的钢圈镀铬 | B. | 室外的铁制水管外面刷油漆 | ||
| C. | 电线外面包上一层塑料 | D. | 地下钢管连接铜块防腐 |
16.下列表示电子式的形成过程正确的是( )
| A. | H+ → → | B. | Na×+ →Na →Na | ||
| C. | Mg${\;}_{×}^{×}$+2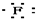 →Mg2+ →Mg2+ | D. |  +${\;}_{×}^{×}$C${\;}_{×}^{×}$ +${\;}_{×}^{×}$C${\;}_{×}^{×}$ → → |
6.若在加入铝粉能放出氢气的无色溶液中,下列各组离子,可能大量共存的是( )
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba 2+ Mg2+ HCO3- | ||
| C. | NO3- K+Mg2+ Cl- | D. | NO3- Na+ K+ Cl- |
13.X、Y、Z三种元素的原子,其核外电子排布分别为:X原子最外层有一个电子,Y原子的第一、二、三层电子数分别为2、8、3,Z原子第一、二层电子数为2、6,由这三种元素组成的化合物的化学式可能是( )
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X2YZ3 |
11.下列反应中,反应后固体物质没有增重的是( )
| A. | 碳酸钡粉末加入到足量稀硫酸中 | B. | Na2O2粉末空气中露置一段时间 | ||
| C. | 铝与足量V2O5发生铝热反应 | D. | 将足量铁屑投入CuCl2溶液 |
 ,X与W组成的化合物中存在共价键(填“离子”“共价”).
,X与W组成的化合物中存在共价键(填“离子”“共价”).