题目内容
【题目】二氧化氯![]() 作为一种高效强氧化剂,已被联合国世界卫生组织
作为一种高效强氧化剂,已被联合国世界卫生组织![]() 列为AⅠ级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中
列为AⅠ级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中![]() 的质量分数高于
的质量分数高于![]() 等均有可能引起爆炸,易与碱液反应生成盐和水。
等均有可能引起爆炸,易与碱液反应生成盐和水。
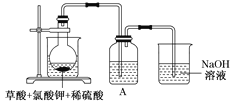
![]() 某研究小组设计如图所示实验制备
某研究小组设计如图所示实验制备![]() 溶液,其反应的化学方程式为
溶液,其反应的化学方程式为![]() 。
。
![]() 在反应开始之前将烧杯中的水加热到
在反应开始之前将烧杯中的水加热到![]() ,然后停止加热,并使其温度保持在
,然后停止加热,并使其温度保持在![]() 之间。控制温度的目的是___________,图中装置中缺少的一种必需的玻璃仪器是_______________________。
之间。控制温度的目的是___________,图中装置中缺少的一种必需的玻璃仪器是_______________________。
![]() 装置A用于溶解产生的二氧化氯气体,其中最好盛放________
装置A用于溶解产生的二氧化氯气体,其中最好盛放________![]() 填标号
填标号![]() 。
。
a.20mL60℃的温水 b.100mL冰水 c.100mL饱和食盐水 d.100mL沸水
![]() 在烧瓶中加入12.25gKClO3和9g草酸
在烧瓶中加入12.25gKClO3和9g草酸![]() ,然后再加入足量的稀硫酸,水浴加热,反应后生成
,然后再加入足量的稀硫酸,水浴加热,反应后生成![]() 的质量为________。
的质量为________。
![]() 用
用![]() 处理过的饮用水
处理过的饮用水![]() 为
为![]() 常含有一定量对人体不利的亚氯酸根离子
常含有一定量对人体不利的亚氯酸根离子![]() 。饮用水中
。饮用水中![]() 、
、![]() 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至![]() ;
;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的![]() 溶液滴定至终点;
溶液滴定至终点;
步骤5:再调节溶液的![]() ;
;
步骤6:继续用相同浓度的![]() 溶液滴定至终点。
溶液滴定至终点。
![]() 步骤1中若要量取20.00mL水样,则应选用的仪器是____________________。
步骤1中若要量取20.00mL水样,则应选用的仪器是____________________。
![]() 步骤
步骤![]() 的目的是测定水样中
的目的是测定水样中![]() 的含量,其反应的化学方程式为2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为______________,滴定达到终点时溶液的颜色变化为______________。
的含量,其反应的化学方程式为2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为______________,滴定达到终点时溶液的颜色变化为______________。
![]() 步骤5的目的是使
步骤5的目的是使![]() 将溶液中的
将溶液中的![]() 还原为
还原为![]() 以测定其含量,该反应的离子方程式为____________________________。
以测定其含量,该反应的离子方程式为____________________________。
【答案】保证反应所需温度、防止温度过高发生爆炸 温度计 b 6.75g 25mL的酸式滴定管![]() 或20.00mL的移液管
或20.00mL的移液管![]() 淀粉溶液 蓝色褪去
淀粉溶液 蓝色褪去 ![]()
【解析】
![]() 由题目所给信息可知,
由题目所给信息可知,![]() 性质非常不稳定,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度。实验中应用温度计控制温度,因为要确保在反应开始之前将烧杯中的水加热到
性质非常不稳定,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度。实验中应用温度计控制温度,因为要确保在反应开始之前将烧杯中的水加热到![]() ,然后停止加热,另一个原因就是保证反应所需的温度,并使其温度保持在
,然后停止加热,另一个原因就是保证反应所需的温度,并使其温度保持在![]() 之间,所以必须要用温度计。
之间,所以必须要用温度计。
故答案为:保证反应所需温度、防止温度过高发生爆炸;温度计;
![]() 二氧化氯易溶于水,则可用水吸收,为防止温度过高或浓度过大而爆炸,应在低温下吸收,则b符合。
二氧化氯易溶于水,则可用水吸收,为防止温度过高或浓度过大而爆炸,应在低温下吸收,则b符合。
故答案为:b;
![]() ,
,![]() ,
,
根据方程式 可知道,
可知道,![]() 过量,用
过量,用![]() 的量计算,则生成的
的量计算,则生成的![]() ,
,![]() 。
。
故答案为:![]() ;
;
![]() 根据题意水样pH为
根据题意水样pH为![]() ,呈酸性,且25mL与所量取的体积接近,故用25mL酸式滴定管或
,呈酸性,且25mL与所量取的体积接近,故用25mL酸式滴定管或![]() 的移液管。
的移液管。
故答案为:![]() 的酸式滴定管
的酸式滴定管![]() 或
或![]() 的移液管
的移液管![]() ;
;
![]() 根据题意可知滴定过程中出现了碘单质,碘遇淀粉变蓝,故选淀粉做指示剂;滴定到终点时,碘单质正好反应完,故滴定达到终点时溶液的颜色变化为溶液蓝色褪去。
根据题意可知滴定过程中出现了碘单质,碘遇淀粉变蓝,故选淀粉做指示剂;滴定到终点时,碘单质正好反应完,故滴定达到终点时溶液的颜色变化为溶液蓝色褪去。
故答案为:淀粉溶液;蓝色褪去;
步骤5的目的是用
![]() 将溶液中的
将溶液中的![]() 还原为
还原为![]() 以测定其含量,则
以测定其含量,则![]() 被氧化为
被氧化为![]() ,故该反应的离子方程式为
,故该反应的离子方程式为![]() 。
。
故答案为:![]() 。
。

【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D