题目内容
关于如图所示的原电池,下列说法正在的是( )


| A、Zn为负极发生还原反应 |
| B、该装置能将电能转化为化学能 |
| C、电子由铜片通过导线流向锌片 |
| D、正极反应式为2H++2e═H2↑ |
考点:原电池和电解池的工作原理
专题:
分析:原电池中,活泼金属作负极,负极发生氧化反应,正极发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极,据此解答.
解答:
解:A.Zn是负极,发生氧化反应,故A错误;
B.该装置为原电池,能将化学能转化为电能,故B错误;
C.Zn为负极,Cu为正极,则电子由锌片通过导线流向铜片,故C错误;
D.Cu为正极,正极上氢离子得电子,则正极反应式为2H++2e-=H2↑,故D正确;
故选D.
B.该装置为原电池,能将化学能转化为电能,故B错误;
C.Zn为负极,Cu为正极,则电子由锌片通过导线流向铜片,故C错误;
D.Cu为正极,正极上氢离子得电子,则正极反应式为2H++2e-=H2↑,故D正确;
故选D.
点评:本题考查原电池,利用氧化还原反应来分析电极反应是解答本题的关键,并熟悉工作原理来解答,难度不大.

练习册系列答案
相关题目
下列变化必须加入其他物质作还原剂才能发生的是( )
| A、CuO→CuCl2 |
| B、H2O→H2 |
| C、I-→I2 |
| D、CO2→CO |
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4?7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3-0.5n]m,制备过程如图所示:下列说法不正确的是( )


| A、炉渣中FeS与硫酸和氧气的反应式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O |
| B、气体M的成分是SO2,通入双氧水得到硫酸,可循环使用 |
| C、溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大 |
| D、向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾 |
核外电子数相等的原子一定是( )
①同种元素②同种核素③质子数相同④质量数相同⑤中子数相同⑥最外层电子数相同.
①同种元素②同种核素③质子数相同④质量数相同⑤中子数相同⑥最外层电子数相同.
| A、①②③⑤ | B、①③⑥ |
| C、①③④⑥ | D、全部 |
橙花醛是一种香料,其结构简式为: .下列说法正确的是( )
.下列说法正确的是( )
 .下列说法正确的是( )
.下列说法正确的是( )| A、橙花醛不能与Br2发生加成反应 |
| B、橙花醛能发生银镜反应 |
| C、1 mol橙花醛最多可以与2 mol H2发生加成反应 |
| D、橙花醛跟乙醛等是同系物 |
下列物质能与水反应生成强酸的是( )
| A、NH3 |
| B、CO2 |
| C、SO3 |
| D、Na2O |
根据下列化学实验事实得出的结论一定正确的是( )
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解.结论:该溶液中有SO42- |
| B、向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝.结论:该溶液中有NH4+ |
| C、向1 mL浓度均为0.05 mol?L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol?L-1的AgNO3溶液,振荡,沉淀呈黄色. 结论:Ksp(AgCl)<Ksp(AgI) |
| D、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀.结论:X中不含有醛基 |
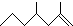 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.
(3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.