题目内容
 如图所示装置中,能观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中合理的是( )
如图所示装置中,能观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中合理的是( )| M | N | P | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铜 | 硫酸铜溶液 |
| A、A | B、B | C、C | D、D |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电流计指针偏转,说明该装置构成原电池,M棒变粗,N棒变细,则N为易失电子的金属作负极,M作正极,电解质溶液中阳离子为不如氢元素活泼的金属元素,据此分析解答.
解答:
解:A.该装置中M电极锌比铜易失电子而作负极,铜作正极,且正极上氢离子得电子生成氢气,所以M电极不变粗,故A错误;
B.该装置中,N电极铁比铜易失电子而作负极,铜作正极,正极上氢离子得电子生成氢气,所以M电极不变粗,故B错误;
C.该装置中,N电极锌比银易失电子而作负极,银作正极,正极上银离子得电子生成银单质,所以M电极变粗,故C正确;
D.该装置中,M电极锌易失电子而作负极,N电极铜作正极,正极上铜离子得电子生成铜电子,所以N电极变粗,故D错误;
故选C.
B.该装置中,N电极铁比铜易失电子而作负极,铜作正极,正极上氢离子得电子生成氢气,所以M电极不变粗,故B错误;
C.该装置中,N电极锌比银易失电子而作负极,银作正极,正极上银离子得电子生成银单质,所以M电极变粗,故C正确;
D.该装置中,M电极锌易失电子而作负极,N电极铜作正极,正极上铜离子得电子生成铜电子,所以N电极变粗,故D错误;
故选C.
点评:本题考查了原电池原理,明确正负极上发生的电极反应是解本题关键,结合反应现象来确定正负极及电解质溶液,题目难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、钠与水的反应:Na+H2O=Na++OH-+H2↑ |
 盐MN溶于水的过程如图所示:下列说法不正确的是( )
盐MN溶于水的过程如图所示:下列说法不正确的是( )| A、MN是强电解质 |
| B、N-结合H+的能力一定比OH-强 |
| C、该过程中c(OH-)>c(H+) |
| D、溶液中存在c(HN)=c(OH-)-c(H+) |
下列有关实验原理或操作不正确的是( )
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、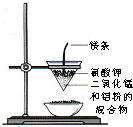 用如图装置制取少量金属锰 |
D、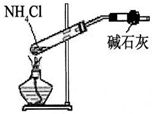 实验室用如图所示装置制取少量氨气 |
下列反应的离子方程式书写正确的是( )
| A、大理石和盐酸的反应:CO32-+2H+=CO2↑+H2O | ||||
| B、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ | ||||
| C、氯气与氢氧化钠溶液反应:Cl2+OH-=Cl-+HClO | ||||
D、电解饱和食盐水:2Cl-+2H2O
|

 则△H2
则△H2