题目内容
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是 (填序号
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得: SiO2+ C+ N2= Si3N4+ CO)
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K=
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 (填两种物质名称),其净水作用的原理是 .
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.选择适宜的催化剂,是否可以提高SO2的转化率?
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得:
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K=
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是
考点:化学实验操作的先后顺序,氧化还原反应方程式的配平,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)抓住除钡离子要放在除碳酸根离子前、盐酸放在最后即可得到顺序关系;
(2)催化剂只影响反应速率,不影响化学平衡,所以不影响转化率和反应热,据此进行解答;
(3)①由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6;
②根据方程式和平衡常数概念写平衡常数表达式;
(4)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的.
(2)催化剂只影响反应速率,不影响化学平衡,所以不影响转化率和反应热,据此进行解答;
(3)①由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6;
②根据方程式和平衡常数概念写平衡常数表达式;
(4)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的.
解答:
解:(1)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,
故答案为:③①②;
(2)催化剂只对反应速率有影响,催化剂不影响化学平衡,所以变化对二氧化硫的转化率产生影响,也不会影响反应放出的热量,
故答案为:否;否;
(3)①由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2
Si3N4+6CO.
故答案为:3、6、2、1、6.
②固体和纯液体的浓度不变,故该反应的平衡常数表达式为:K=
,故答案为:
;
(4)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾、硫酸铝、硫酸铁、硫酸亚铁等,
故答案为:明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任何两种);铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的.
故答案为:③①②;
(2)催化剂只对反应速率有影响,催化剂不影响化学平衡,所以变化对二氧化硫的转化率产生影响,也不会影响反应放出的热量,
故答案为:否;否;
(3)①由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2
| ||
故答案为:3、6、2、1、6.
②固体和纯液体的浓度不变,故该反应的平衡常数表达式为:K=
| c6(CO) |
| c2(N2) |
| c6(CO) |
| c2(N2) |
(4)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾、硫酸铝、硫酸铁、硫酸亚铁等,
故答案为:明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任何两种);铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的.
点评:本题考查了粗盐的提纯、催化剂原理、方程式的配平、化学平衡常数表达式、书写盐类水解的应用,题目难度中等,注意掌握化学方程式常用的配平方法.

练习册系列答案
相关题目
对于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是( )
| A、正反应进行的程度大,正反应速率一定大 |
| B、化学反应速率变化时,化学平衡一定发生移动 |
| C、化学平衡发生移动时,化学反应速率一定变化 |
| D、对于正反应为放热的化学反应,升高温度平衡逆向移动,逆反应速率减小 |
 过硫酸:
过硫酸:
 (b)
(b)  (c)H2O2(d)
(c)H2O2(d)  (e)
(e)  (f)
(f)  (g)O3(h)
(g)O3(h) 
 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示: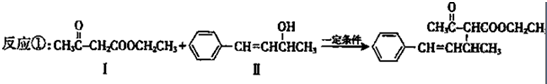
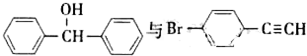 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为 表示的分子式
表示的分子式