题目内容
X是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K,相对分子质量334.在343K时能将一氧化碳定量地转变为CO2,这一性质被用于合成氨厂中测定合成气中CO的含量.
(1)写出X的化学式及其热分解反应方程式
(2)写出X与CO反应的化学方程式,并简述X能用于测定合成气中CO含量的理由.
(3)画出X的分子结构示意图
(4)X的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y,Y是制造一种灭火器的原料,写出上述两步反应的化学方程式.
(1)写出X的化学式及其热分解反应方程式
(2)写出X与CO反应的化学方程式,并简述X能用于测定合成气中CO含量的理由.
(3)画出X的分子结构示意图
(4)X的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y,Y是制造一种灭火器的原料,写出上述两步反应的化学方程式.
考点:化学方程式的有关计算
专题:计算题
分析:(1)X是碘一氧系中研究得最多的稳定化合物,则X含碘和氧两种元素,根据相对分子质量334推测化学式,以及其热分解反应方程式;
(2)I2O5分解生成碘单质和氧气,根据题干信息在343K时能将一氧化碳定量地转变为CO2书写方程式;
(3)根据碘原子、氧原子的核外电子排布和电负性分析解答;
(4)氯仿为CHCl3,Y是制造一种灭火器的原料为CCl4,结合题干信息即可书写相关反应的化学方程式.
(2)I2O5分解生成碘单质和氧气,根据题干信息在343K时能将一氧化碳定量地转变为CO2书写方程式;
(3)根据碘原子、氧原子的核外电子排布和电负性分析解答;
(4)氯仿为CHCl3,Y是制造一种灭火器的原料为CCl4,结合题干信息即可书写相关反应的化学方程式.
解答:
解:(1)X是碘一氧系中研究得最多的稳定化合物,则X含碘和氧两种元素,设化学式为ImOn,则127m+16n=334,m≤3,当m=2,n=5时符合,所以X的化学式为I2O5,在343K时能将一氧化碳定量地转变为CO2,说明能释放氧分子,所以其热分解反应方程式为:2I2O5
2I2+5O2↑,
答:I2O5;2I2O5
2I2+5O2↑;
(2)X为I2O5,与CO反应的化学方程式为I2O5+5CO
I2+5CO2,X能用于测定合成气中CO含量是因为:因该反应完全定量进行,用碘量法一硫代硫酸钠滴定反应释放出的I2,即可定量测定合成气中CO含量,
答:I2O5+5CO
I2+5CO2,因该反应完全定量进行,用碘量法一硫代硫酸钠滴定反应释放出的I2,即可定量测定合成气中CO含量;
(3)X为I2O5,碘原子最外层为7个电子需1个成键电子,氧原子最外层为6个电子需2个成键电子,碘和氧成键,因电负性:O>I,所以碘提供孤对电子给氧,所以X的分子结构示意图为: ,
,
答: ;
;
(4)I2O5的中的碘为+5价,其水溶液为HIO3,添加盐酸发生反应2HIO3+10HCl=I2+5Cl2↑+6H20或HIO3+5HCl=ICl3+Cl2↑+3H20,并将逸出的气体Cl2通入氯仿CHCl3中发生反应:Cl2+CHCl3=HCl+CCl4或Cl2+2CHCl3=H2+2CCl4,得化合物CCl4,
答:2HIO3+10HCl=I2+5Cl2↑+6H20或HIO3+5HCl=ICl3+Cl2↑+3H20,Cl2+CHCl3=HCl+CCl4或Cl2+2CHCl3=H2+2CCl4.
| ||
答:I2O5;2I2O5
| ||
(2)X为I2O5,与CO反应的化学方程式为I2O5+5CO
| ||
答:I2O5+5CO
| ||
(3)X为I2O5,碘原子最外层为7个电子需1个成键电子,氧原子最外层为6个电子需2个成键电子,碘和氧成键,因电负性:O>I,所以碘提供孤对电子给氧,所以X的分子结构示意图为:
 ,
,答:
 ;
;(4)I2O5的中的碘为+5价,其水溶液为HIO3,添加盐酸发生反应2HIO3+10HCl=I2+5Cl2↑+6H20或HIO3+5HCl=ICl3+Cl2↑+3H20,并将逸出的气体Cl2通入氯仿CHCl3中发生反应:Cl2+CHCl3=HCl+CCl4或Cl2+2CHCl3=H2+2CCl4,得化合物CCl4,
答:2HIO3+10HCl=I2+5Cl2↑+6H20或HIO3+5HCl=ICl3+Cl2↑+3H20,Cl2+CHCl3=HCl+CCl4或Cl2+2CHCl3=H2+2CCl4.
点评:本题考查了I2O5的性质,理解给予的反应信息是解题的关键,注意(3)根据电负性判断配位键碘提供孤对电子给氧,题目难度较大.

练习册系列答案
相关题目
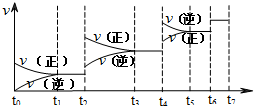 可逆反应C(s)+H2O(g)═H2(g)+CO(g),△H>0达
可逆反应C(s)+H2O(g)═H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件,反应速率v与时间t的关系
如图.图中表示平衡混合物中CO的含量最高的一段时间
是( )
| A、t1-t2 |
| B、t3-t4 |
| C、t5-t6 |
| D、t6-t7 |
下列有关化学反应速率的说法正确的是( )
| A、100 mL 1 mol?L-1的硫酸跟锌片反应,加入适量的硫酸钠溶液,反应速率不变 |
| B、SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| C、汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| D、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=2.0×10-3mol/(L?min) |
| B、其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) |
| C、该温度下此反应的平衡常数K=144 |
| D、其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
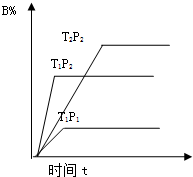 已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分
已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分数(B%)的关系曲线.由曲线分析下列判断正确的是( )
| A、T1<T2 P1>P2m+n>p 正反应为吸热反应 |
| B、T1>T2 P2>P1 m+n<p 正反应为吸热反应 |
| C、T2>T1 P2>P1m+n<p 正反应为吸热反应 |
| D、T1>T2 P2>P1 m+n<p 正反应为放热反应 |
加热纯碱和小苏打的混合物20克,至质量不再变化为止,冷却后称量其固体质量是13.8克,则原混合物中纯碱的质量分数是( )
| A、84% | B、8.4% |
| C、1.6% | D、16% |
下列晶体中只存在着一种相互作用的是( )
| A、石墨 |
| B、NaOH |
| C、CH3COOH |
| D、SiO2 |