题目内容
用物质的量均是0.1mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),下列对该混合溶液的判断正确的是( )
| A、c(H+)>c(OH-) |
| B、c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=0.1mol?L-1 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:等物质的量浓度的醋酸和醋酸钠溶液中,c(CH3COO-)>c(Na+),根据电荷守恒可得:c(H+)>c(OH-),溶液显示酸性,=说明则醋酸的电离程度大于其水解程度,再结合电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)、物料守恒c(CH3COO-)+c(CH3COOH)=0.2 mol?L-1对各选项进行判断.
解答:
解:A.等物质的量浓度的醋酸和醋酸钠溶液中,c(CH3COO-)>c(Na+),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可得:c(H+)>c(OH-),故A正确;
B.根据混合液中的物料守恒得:c(CH3COO-)+c(CH3COOH)=0.2 mol?L-1,故B错误;
C.混合溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,则c(CH3COOH)<c(CH3COO-),故C错误;
D.根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),钠离子不水解,所以钠离子浓度为0.1mol/L,则c(CH3COO-)+c(OH-)=c(Na+)+c(H+)>0.1mol/L,故D错误;
故选A.
B.根据混合液中的物料守恒得:c(CH3COO-)+c(CH3COOH)=0.2 mol?L-1,故B错误;
C.混合溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,则c(CH3COOH)<c(CH3COO-),故C错误;
D.根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),钠离子不水解,所以钠离子浓度为0.1mol/L,则c(CH3COO-)+c(OH-)=c(Na+)+c(H+)>0.1mol/L,故D错误;
故选A.
点评:本题考查了溶液中离子浓度大小的比较,题目难度中等,根据电荷守恒确定溶液的酸碱性及酸的电离程度和酸根离子水解程度相对大小,再结合电荷守恒和物料守恒解答,选项D为易错点,注意利用电荷守恒分析.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
不具备食品防腐作用的物质是( )
| A、醋 | B、糖 | C、食盐 | D、水 |
下列鉴别方法可行的是( )
| A、用银氨溶液鉴别HCOOCH3和CH3CHO |
| B、用溴水鉴别乙烯和乙炔 |
| C、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| D、用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
下列冶炼金属的化学原理错误的是( )
A、2NaCl(熔融)
| ||||
B、MgO+H2
| ||||
C、2Al2O3(熔融)
| ||||
D、Fe2O3+3CO
|
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A、通常状况下,干燥的氯气能和Fe反应 |
| B、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A、增加压强 |
| B、降低温度 |
| C、增大CO的浓度 |
| D、更换催化剂 |
下列叙述正确的是( )
| A、氯气溶于水形成的溶液能导电,故氯气是电解质 |
| B、没有氧元素参加的反应一定不是氧化还原反应 |
| C、在水中能电离出H+的化合物一定是酸 |
| D、有单质生成的分解反应一定是氧化还原反应 |
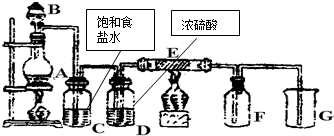 如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.