题目内容
6.向铁和氧化铁的混合物中加入480ml 0.250mol•L-1稀盐酸后恰好完全溶解,得到只含一种金属离子的浅绿色溶液,并收集到672ml氢气(标准状况下测定).回答下列问题;(1)实验室欲用浓度为10.0mol•L-1的浓盐酸配制480ml 0.250mol•L-1的稀盐酸,则需要取上述浓盐酸12.5ml.
(2)原混合物中单质铁的质量为2.24g.
分析 铁粉和氧化铁的混合物与稀盐酸恰好完全反应,当固体粉末完全溶解时,收集到标况下的H2672ml物质的量为:$\frac{672×0.001}{22.4}$=0.03mol,得到只含一种金属离子的浅绿色溶液,说明最终得到氯化亚铁,发生反应为:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,根据铁和盐酸反应方程式知,生成0.03mol氢气需要盐酸的物质的量为0.06mol,根据铁守恒,氧守恒及可以求单质铁的质量,由此分析解答.
解答 解:(1)浓盐酸配制480ml,应选用500ml的容量瓶,根据溶质的物质的量守恒可得:500ml×0.250mol•L-1=10.0mol•L-1V,解之得V=12.5mL,故答案为:12.5;
(2)得到只含一种金属离子的浅绿色溶液,所以最后得到单一溶液氯化亚铁,则氯化亚铁的物质的量为:$\frac{0.48×0.25}{2}$=0.06mol,盐酸中的氢离子一部分与氧化铁中的氧结合成水,还有一部分生成氢气,根氧守恒可知:Fe2O3~3H2O~6HCl,
1mol 6mol
n(Fe2O3) 0.48×0.25-0.03×2
解之得:n(Fe2O3)=0.01mol,所以单质铁的物质的量为:0.06mol-0.01mol×2=0.04mol,则单质铁的质量为:0.04mol×56g/mol=2.24g,故答案为:2.24.
点评 本题考查了混合物的计算,明确发生的反应是解本题关键,注意根据守恒思想进行计算,难度中等.

 计算高手系列答案
计算高手系列答案| A. | 氮 | B. | 氯 | C. | 溴 | D. | 碘 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 1molH2O2的质量为34g•mol-1 | |
| B. | C2H5OH的摩尔质量为46g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 1mol任何物质均含有6.02×1023个分子 |
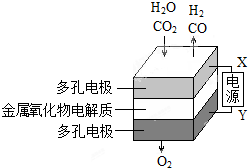 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体可制备H2和CO是一种新的能源利用方式,基本原理如图所示:
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体可制备H2和CO是一种新的能源利用方式,基本原理如图所示: 、,
、,