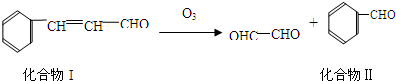
题目内容
在一定条件下,反应N2+3H2═2NH3在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A、v(H2)=0.03mol?L-1?min-1 |
| B、v(N2)=0.02mol?L-1?min-1 |
| C、v(NH3)=0.17mol?L-1?min-1 |
| D、v(NH3)=0.01mol?L-1?min-1 |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据v=
计算v(NH3),再根据速率之比等于化学计量数之比计算其它物质的反应速率.
| △c |
| △t |
解答:
解:在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,氨气的物质的量=
=0.1mol,故v(NH3)=
=0.01mol/(L.min),
A.速率之比等于化学计量数之比,故v(H2)=1.5v(NH3)=0.015mol/(L.min),故A错误;
B.速率之比等于化学计量数之比,故v(N2)=0.5v(NH3)=0.005mol/(L.min),故B错误;
C.由上述计算可知,v(NH3)=0.01mol/(L.min),故C错误;
D.由上述计算可知,v(NH3)=0.01mol/(L.min),故D正确;
故选D.
| 1.7g |
| 17g/mol |
| ||
| 5min |
A.速率之比等于化学计量数之比,故v(H2)=1.5v(NH3)=0.015mol/(L.min),故A错误;
B.速率之比等于化学计量数之比,故v(N2)=0.5v(NH3)=0.005mol/(L.min),故B错误;
C.由上述计算可知,v(NH3)=0.01mol/(L.min),故C错误;
D.由上述计算可知,v(NH3)=0.01mol/(L.min),故D正确;
故选D.
点评:本题考查化学反应速率计算,比较基础,常用定义法及速率规律解答,根据情况选择合适的方法.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列做法中正确的是( )
| A、除去乙烷中少量的乙烯:与适量的氢气混合加热,把乙烯转化为乙烷 |
| B、除去苯中的少量苯酚:加入浓溴水振荡、静置后过滤,除去三溴苯酚沉淀 |
| C、为加快反应速率,制乙炔时用食盐水代替水 |
| D、提取碘水中的碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法不正确的是( )
| A、Na2O2在反应中只作氧化剂 |
| B、O2是氧化产物 |
| C、Na2FeO4既是氧化产物又是还原产物 |
| D、2 mol FeSO4发生反应时,共有8 mol电子转移 |
下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
| A、大理石、玻璃、氯化钾、高氯酸、干冰 |
| B、盐酸、水煤气、硫酸、醋酸、氯气 |
| C、明矾、水泥、苛性钠、亚硫酸、熟石灰 |
| D、冰醋酸、漂白粉、BaSO4、氟化氢、氨气 |
可用分液漏斗分离的一组混合物是( )
| A、硝基苯和酒精 | B、溴苯和溴 |
| C、甲苯和水 | D、硝基苯和水 |
反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行.下列条件的改变对其反应速率几乎无影响的是( )
| A、压缩容器体积,增大体系压强 |
| B、加入适当的催化剂 |
| C、保持压强不变,充入惰性气体使容器容积增大 |
| D、保持容器容积不变,充入惰性气体使体系压强增大 |
欲除去CO2气体中混有的SO2气体,不可以使用的试剂是( )
| A、酸性高锰酸钾溶液 |
| B、饱和碳酸氢钠溶液 |
| C、溴水 |
| D、饱和碳酸钠溶液 |
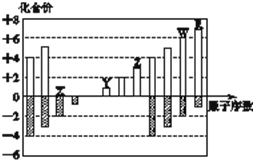 如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:R>W |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、Y和Z两者最高价氧化物对应的水化物不能相互反应 |
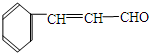 成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):
成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):