题目内容
11.前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.(1)六种元素中第一电离能最小的是K;(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂);请写出黄血盐的化学式K4[Fe(CN)6],1mol AB-中含有π键的数目为2NA(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及def(填序号);
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2═CH2、②HC≡CH、③
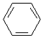 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键.
分析 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)金属性越强,其第一电离能最小;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,黄血盐晶体中含有离子键、配位键、共价键;
(3)只有②中C为sp杂化,①③④均为平面结构,平面结构中C为sp2杂化,HCHO与氢气发生加成反应生成甲醇,甲醇分子间含氢键.
解答 解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
故答案为:K;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol CN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:K4[Fe(CN)6];2NA;def;
(3)①CH2=CH2、③
故答案为:①③④;平面三角;加成产物CH3OH分子之间能形成氢键.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律、原子结构与性质的应用,题目难度不大.

 智慧小复习系列答案
智慧小复习系列答案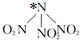 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )| A. | 分子中 N、O 间形成的共价键是极性键 | |
| B. | 图中加“*”N原子的杂化方式为sp3 | |
| C. | 该物质既有氧化性又有还原性 | |
| D. | 15.2g 该物质含有 6.02×1022个原子 |
| A. | H2 | B. | H2O | C. | NH4Cl | D. | CaCl2 |
| A. | 蔗糖水解生成互为同分异构体的葡萄糖和果糖 | |
| B. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| C. | C4H9Cl有4种同分异构体 | |
| D. | 油脂和蛋白质都属于高分子化合物 |
| A. | 1.5 mol•L-1 | B. | 2 mol•L-1 | C. | 2.5 mol•L-1 | D. | 3 mol•L-1 |
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3受热易分解,可通过加热方法除去碳酸钠中的碳酸氢钠杂质 | |
| C. | Na2O2能与水或二氧化碳反应产生氧气,可用作宇航员的供氧剂 | |
| D. | Al2O3熔点高,可用作耐高温材料 |
①加热试管时,先均匀加热,后局部加热
②用排水法收集汽体时,先移出导管后撤酒精灯
③制取物质时,先检查装置气密性后装药品
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净
⑤做H2还原CuO实验时,先通H2流后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2点燃可燃性气体(如H2、CH4、C2H2等)时,先检验气体纯度后点燃.
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(1)2min内Z的反应速率v(Z)=0.05mol•L-1•min-1.
(2)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(3)方程式中m=1,n=4,p=2,q=3.
(4)对于该反应,能增大正反应速率的措施是CD
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度
(5)该反应达到化学平衡状态时D
A.反应停止了 B.正反应速率与逆反应速率均为0
C.反应物与生成物浓度相等 D.正反应速率与逆反应速率相等.
| A. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr两原子的核外电子总数相等 | |
| B. | ${\;}_{40}^{95}$Zr的中子数和电子数之差为55 | |
| C. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr是同种核素 | |
| D. | ${\;}_{40}^{95}$Zr属于非金属元素 |