题目内容
10.某二元酸(简写为H2A)溶液,在水中的电离方程式是:H2A═H++HA- HA-?H++A2-①常温下,0.1mol/L H2A溶液的pH<1(填“>”、“<”或“=”);
②在0.1mol/L NaHA溶液中,各离子浓度由大到小的顺序是:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
③100℃时,水的离子积为1×10-12则0.005mol/L Ba(OH)2溶液的pH=10.
分析 ①根据H2A═H++HA-可知,该酸的第一步完全电离,则0.1mol/L H2A溶液中氢离子浓度大于0.1mol/L;
②NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离分析;
③先计算出溶液中氢氧根离子浓度,然后根据水的离子积计算出溶液中的氢离子浓度,再计算出该溶液的pH.
解答 解:①H2A在水中的电离方程式是:H2A═H++HA-、HA-?H++A2-,其第一步电离是完全电离,则常温下,0.1mol/L H2A溶液中氢离子浓度大于0.1mol/L,其溶液的pH<1,
故答案为:<;
②NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
③解:0.005mol/L Ba(OH)2溶液中氢氧根离子浓度为0.01mol/L,100℃时,水的离子积为1×10-12,则该溶液中氢离子浓度为:$\frac{1×1{0}^{-12}}{0.01}$mol/L=10-10mol/L,
所以该溶液的pH=-lgc(H+)=10,
故答案为:10.
点评 本题考查了离子浓度大小比较、溶液pH的计算等知识,题目难度中等,明确溶液酸碱性溶液溶液pH的计算方法为解答关键,注意掌握判断离子浓度大小的方法.

练习册系列答案
相关题目
1.根据元素性质递变规律,下列判断不正确的是( )
| A. | 酸性:H2SiO3<H3PO4<H2SO4 | B. | 电负性:I>Cl>Br>F | ||
| C. | 第一电离能:N>O>C | D. | 沸点:H2O>H2Te>H2Se>H2S |
18.含有电子数均为3.01×1024的NH3和CH4,两者一定具有相同的( )
| A. | 质量 | B. | 体积 | C. | 物质的量 | D. | 氢原子数 |
19.化学与日常生活密切相关.下列说法不正确的是( )
| A. | 硅胶可作袋装食品的干燥剂 | B. | 84消毒液的有效成分是NaClO | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 氢氧化铝可作胃酸的中和剂 |
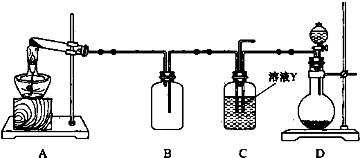
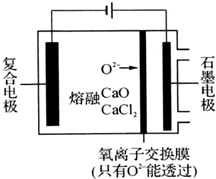 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下: