题目内容
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景.
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如图所示:

①试剂①宜选用石灰乳且必须过量,过量的目的是 .
②镁蒸气宜在 (填序号)气体冷却后得到镁锭(A.N2 B.CO2 C.Ar D.空气)
(2)工业以浓缩海水为原料提取溴的部分过程如图:

某课外小组在实验室模拟上述过程设计如图所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
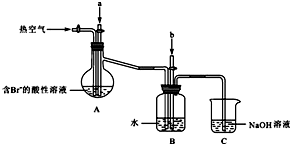
③A装置中通入a气体时,反应的离子方程式表示为: .
④A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是: .
⑤反应过程中,B装置中产生的两种主要阴离子为 .
⑥C装置的作用是 .
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如图所示:

①试剂①宜选用石灰乳且必须过量,过量的目的是
②镁蒸气宜在
(2)工业以浓缩海水为原料提取溴的部分过程如图:

某课外小组在实验室模拟上述过程设计如图所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

③A装置中通入a气体时,反应的离子方程式表示为:
④A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是:
⑤反应过程中,B装置中产生的两种主要阴离子为
⑥C装置的作用是
考点:物质分离和提纯的方法和基本操作综合应用,海水资源及其综合利用
专题:实验题
分析:(1)在海水中加入足量的石灰乳,可使氢氧化镁沉淀完全,经过滤、洗涤、干燥后电解可生成镁,镁性质活泼,易与氧气、氮气以及CO2反应;
(2)氯气和与溴化钠反应生成溴,发生Cl2+2Br-=Br2+2Cl-;然后通入二氧化硫发生SO2+Br2+2H2O=4H++2Br-+SO42-,可起到富集的作用,最后用氯气氧化再重新生成溴,尾气中含有Cl2、Br2、SO2等有毒气体,可用NaOH溶液吸收.
(2)氯气和与溴化钠反应生成溴,发生Cl2+2Br-=Br2+2Cl-;然后通入二氧化硫发生SO2+Br2+2H2O=4H++2Br-+SO42-,可起到富集的作用,最后用氯气氧化再重新生成溴,尾气中含有Cl2、Br2、SO2等有毒气体,可用NaOH溶液吸收.
解答:
解:(1)①过量的石灰乳能使Mg2+完全转化为Mg(OH)2沉淀,故答案为:使Mg2+完全转化为Mg(OH)2沉淀;
②镁是活泼的金属,能和氧气、氮气以及CO2反应,所以应该在Ar中冷却,故答案为:C;
(2)③a气体应该是氯气,能把溴离子氧化生成单质溴,反应的离子方程式是Cl2 +2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
④通入热空气能将溴从蒸馏烧瓶A中吹出,提高产量,故答案为:将溴从蒸馏烧瓶A中吹出;
⑤b气体是SO2,溴水能把SO2氧化生成溴化氢和硫酸,所以B装置中产生的两种主要阴离子为SO42-、Br-,故答案为:SO42-、Br-;
⑥氢氧化钠能吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气,故答案为:吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气.
②镁是活泼的金属,能和氧气、氮气以及CO2反应,所以应该在Ar中冷却,故答案为:C;
(2)③a气体应该是氯气,能把溴离子氧化生成单质溴,反应的离子方程式是Cl2 +2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
④通入热空气能将溴从蒸馏烧瓶A中吹出,提高产量,故答案为:将溴从蒸馏烧瓶A中吹出;
⑤b气体是SO2,溴水能把SO2氧化生成溴化氢和硫酸,所以B装置中产生的两种主要阴离子为SO42-、Br-,故答案为:SO42-、Br-;
⑥氢氧化钠能吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气,故答案为:吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气.
点评:本题考查海水的综合应用、离子方程式的书写、尾气处理,是中等难度的试题,试题注重基础和能力的双向考查,有助于培养学生的逻辑思维能力和创新思维能力.也有利于考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列物质中,既有离子键,又有共价键的是( )
| A、NaCl |
| B、CO2 |
| C、NH4Cl |
| D、NH3 |
甲酸乙酯和乙酸丁酯的混合物中,碳元素的质量分数为58.5%,则氢元素质量分数为( )
| A、41.5% |
| B、31.75% |
| C、20.5% |
| D、9.75% |
下列各组互为同位素的是( )
A、
| ||||
| B、H2和D2 | ||||
| C、H2O和D2O | ||||
| D、O2和O3 |
能用离子方程式H++OH═H2O表示的反应是( )
| A、稀醋酸和稀氨水反应 |
| B、稀硫酸和烧碱溶液反应 |
| C、稀盐酸和氢氧化铜反应 |
| D、稀硫酸和氢氧化钡溶液反应 |
需要加入氧化剂才能发生的变化是( )
| A、HCO3-→CO2 |
| B、Cl-→Cl2 |
| C、MnO4-→Mn2+ |
| D、Fe3+→Fe2+ |


