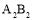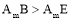题目内容
如下图所示,利用海水可提取很多重要的化工原料。

下列有关说法正确的是
A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
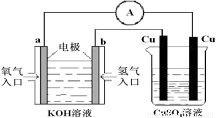
B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置
C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2
D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原
D
【解析】
试题分析: A、除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,除硫酸根离子用BaCl2溶液,除钙离子用Na2CO3溶液,除镁离子、铁离子用NaOH溶液,为保证杂质离子除尽所加试剂需过量,碳酸钠溶液的作用为除去钙离子和过量的钡离子,碳酸钠溶液应在氯化钡溶液之后加入,错误;B、氯碱工业中,电解池的阳极材料应是惰性的,错误;C、为防止镁离子水解,结晶水合物失去结晶水生成氯化镁,应在氯化氢气流中加热,错误;D、第⑤、⑥步是溴的提纯,既有溴元素被氧化也有溴元素被还原,正确。
考点:考查海水的综合利用。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目

 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 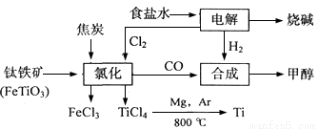
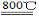 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。