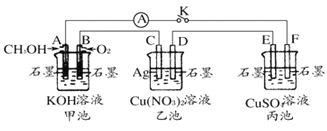
题目内容
【题目】下列关于反应热的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B.甲烷的燃烧热为890.3kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
C.一定条件下,将0.5molN2和l.5molH2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
D.若S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2(g) △H2;△H1<△H2
【答案】B
【解析】
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时放热大于57.3kJ,因为SO42-+Ba2+=BaSO4↓会释放热量,A错误;
B. 从甲烷为1mol,产物CO2(g)、H2O(l)的组成和状态,燃烧热为890.3kJ·mol-1三点分析, CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1是表示甲烷燃烧热的热化学方程式,B正确;
C. 一定条件下,将0.5molN2和l.5molH2置于密闭容器中充分反应生成NH3,放热19.3kJ,但实际参加反应的N2<0.5mol,因此无法计算反应热,C错误;
D. 若S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2(g) △H2;由于S(s)→S(g)需要吸热,所以后者放出的热量多,但由于△H为负值,所以△H1>△H2,D错误。
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__。在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH___0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___。
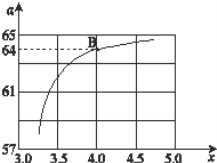
(3)图中的B点对应的NH3的平衡转化率为__。