题目内容
5.以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)△H=+569.99kJ/mol,欲使该反应发生并维持该反应进行的条件是C.
(a)常温 (b)常温,并通入少量CO2 (c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式:2Na2S+1Na2CO3+4SO2=3Na2S2O3+1CO2.
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是防止NH4HCO3分解,提高NH4HCO3利用率和NaHCO3产率.
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO42-都大量减少,该物质是Ba(OH)2.
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因:Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O++H+.
分析 (1)根据反应的化学方程式可知,该反应为吸热反应,欲使该反应发生并维持该反应进行的条件是加热;
(2)根据氧化还原反应中氧化剂和还原剂得失电子守恒结合质量守恒定律配平反应的化学方程式;
(3)NH4HCO3在高温下易分解;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少;
(5)反应Ⅳ中两种盐溶液分别含有NH4+和Fe2+离子都易水解,加入硫酸可以抑制其水解;
解答 解:(1)根据反应的化学方程式可知,该反应为吸热反应,根据影响化学反应的因素可知,欲使该反应发生并维持该反应进行的条件是加热,
故选C;
(2)根据氧化剂与还原剂得失电子数目相等,则有Na2S~2SO2,结合元素质量守恒,可写出化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,
故答案为:2;1;4;3;1;
(3)NH4HCO3在高温下易分解,反应Ⅲ温度需控制在35~40℃的较低温度,以提高NH4HCO3利用率和NaHCO3产率,
故答案为:防止NH4HCO3分解,提高NH4HCO3利用率和NaHCO3产率;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少,则应加入Ba(OH)2,
故答案为:Ba(OH)2;
(5)反应Ⅳ中两种盐溶液分别含有NH4+和Fe2+离子都易水解,加入硫酸可以抑制其水解,水解的离子方程式为Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O++H+,
故答案为:Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O++H+.
点评 本题考查较为综合,设计氧化还原反应、离子反应等问题,侧重于对学生分析问题和解决问题的能力的考查,题目难度中等,注意氧化还原反应的配平.

| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C可能都是液体酶 |
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下 11.2 L NO与11.2L O2混合,充分反应后所含分子数为0.75NA | |
| C. | 标准状况下,22.4 LCO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加500mL1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、D的化学式为:ACuSO4;DAl(NO3)3.
(2)写出步骤①中生成沉淀的反应的离子方程式Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓.
(3若向E的饱和溶液中通入足量的CO2,现象是溶液由澄清变浑浊,原因是Na2CO3+CO2+H2O=2NaHCO3↓,由于NaHCO3的溶解度小于Na2CO3溶解度,并且溶质的质量增加同时溶剂的质量减少,因此会有晶体析出而变浑浊(用化学方程式及必要的文字说明解释).
(4)步骤⑤中产生的有害气体可用NaOH溶液吸收.
| 实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
| ① | 300 | 2.00 | 2.80 |
| ② | 400 | 2.00 | 3.00 |
| ③ | 400 | 4.00 | a |
| A. | 上述反应中,△H<0 | |
| B. | 实验②中,该反应的平衡常数K=0.5 | |
| C. | 实验①经4 min达到平衡,0~4 min内υ(X)=0.2mol•L-1•min-1 | |
| D. | 实验③中a=6.00 |
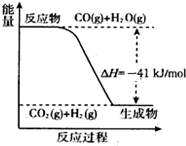 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
(1)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
(2)该反应为放热反应(填“吸热”或“放热”).
(3)增加H2O(g)的浓度,CO的转化率将增大(填“增大”、“减小”或“不变”).
(4)830℃时,向该容器中加入2molCO2与2molH2,平衡时CO2的体积分数是25%.
(5)已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.又已知2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol. 结合图象写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol.

 .
.