��Ŀ����
10��ʵ����������ͼ��ʾ��ʵ��װ����ȡ��������ˮCuCl2������֪NaCl+H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$NaHSO4+HCl����

�ش��������⣺
��1��ʵ��ǰ�������װ�õ������Եķ����ǹرշ�Һ©��������װ�����Ӻú�����ĩ�˷���ʢˮ���ձ��У��þƾ�������ƿ���ձ��еĵ��ܿ�������ð����ֹͣ���ȣ����ܿڲ��γ�һ��ˮ������������װ�ò�©����
��2��װ�ã�B���Ĺ��ƿ��ʢ����ʳ��ˮ��д���ƣ����������dz�ȥCl2�е�HCl��װ�ã�C���Ĺ��ƿ��ʢŨ���ᣨд���ƣ����������dz�ȥCl2�е�ˮ������װ�ã�E�����ձ���ʢ����������Һ��д���ƣ��������������ն�����������ֹ��Ⱦ��
��3��װ�ã�A���з�����Ӧ�Ļ�ѧ����ʽ��2NaCl+3H2SO4��Ũ��+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$2NaHSO4+Cl2��+MnSO4+H2O��װ�ã�A���з�����Ӧ�Ļ�ѧ����ʽ��Cl2+2NaOH=NaClO+NaCl+H2O��
���� ��1������������μӻ������ʵ�飬ʵ��ǰһ��Ҫ���װ�õ������ԣ��Է�װ��©��Ӱ��ʵ������װ�������Լ���ԭ��һ����ͨ��ѹǿ�����������Ե��������жϣ�
��2����A���Ƶõ��������������Ȼ��⡢ˮ����������ͨ��ʢ�б���ʳ��ˮ����Ũ�����ϴ��ƿ��ȥ��
��3��װ�ã�A���з�����Ӧ�Ļ�ѧ����ʽ�Ƕ������̺�Ũ���ᡢ�Ȼ��ƹ�����ȷ�Ӧ���������������ж������������ƽ���β���������չ�����������
��� �⣺��1��װ�������Լ��ķ�����װ�����Ӻú�����ĩ�˷���ʢˮ���ձ��У��þƾ�������ƿ���ձ��еĵ��ܿ�������ð����ֹͣ���ȣ����ܿڲ��γ�һ��ˮ������������װ�ò�©����
�ʴ�Ϊ���رշ�Һ©��������װ�����Ӻú�����ĩ�˷���ʢˮ���ձ��У��þƾ�������ƿ���ձ��еĵ��ܿ�������ð����ֹͣ���ȣ����ܿڲ��γ�һ��ˮ������������װ�ò�©����
��2����A���Ƶõ��������������Ȼ��⡢ˮ����������ͨ��ʢ�б���ʳ��ˮ����Ũ�����ϴ��ƿ��ȥ��װ��E������������Һ��ʣ�������ͨ������������Һ ���ն�����������ֹ��Ⱦ������
�ʴ�Ϊ������ʳ��ˮ����ȥCl2�е�HCl��Ũ�����ȥCl2�е�ˮ����������������Һ ���ն�����������ֹ��Ⱦ��
��3��װ�ã�A���з�����Ӧ�Ļ�ѧ����ʽ�Ƕ������̺�Ũ���ᡢ�Ȼ��ƹ�����ȷ�Ӧ������������Ӧ�Ļ�ѧ����ʽΪ��2NaCl+3H2SO4��Ũ��+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$2NaHSO4+Cl2��+MnSO4+H2O��װ��E���������������Ʒ�Ӧ����ֹ��Ⱦ��������Ⱦ��������Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��2NaCl+3H2SO4��Ũ��+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$2NaHSO4+Cl2��+MnSO4+H2O��Cl2+2NaOH=NaCl+NaClO+H2O��
���� ������������ʵ���Һ����ʵļ������飬����ؼ���������������ʣ��ͳ��������Ʊ��������ơ�����ķ������Ǹ߿����ȵ㣬��Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ����������CaCl2��Һ�������˰�ɫ����������Һ��һ�����д�����CO32- | |
| B�� | NaCl��Һ��Na2CO3��������ʱ������ɫ��ͬ | |
| C�� | ͨ�����ȵ�CuO����ʹ�����ɺڱ�������һ����H2 | |
| D�� | �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO42- |
| ��� | �� | �� | �� | �� | �� |
| ���� | ʳ�� | �� | ����ˮ | ʯ��ˮ | ������Һ |
| ��Ҫ�ɷ� | CH3COOH | C2H5OH | C12H22O11 | Ca��OH��2 | Na2CO3 |
| ��ҺPH | 3 | 7 | 7 | 11 | 10 |
��1�����ϱ��١�������Ҫ�ɷֽ��з��ࣨ����ţ���ͬ������������Ǣ٣����ڼ���Ǣܣ������ε��Ǣݣ������л�����Ǣ٢ڢۣ�
��2�������˱��ó棨�ͷ�һ���������ʣ���ҧ��Ϊ������ʹ�������˴�Ϳ�ܢݣ�
��3���þõ���������ˮ������Ҫ�ɷ�ΪCaCO3��Mg��OH��2���â�������������
�ֱ���ʢ��0.5g Na2CO3���塢0.5gNaHCO3������ձ��м���10mLˮ��20�棩�����裬�����¶� ΪT1��
���ú��º�����¶�ΪT2��
�ֱ����10mL �ܶ�ԼΪ1.1g/mL 20%�����ᣨ20�棩�����裬�����¶�T3��
�õ��±������ݣ�
| �¶� �Լ� | T1/�� | T2/�� | T2/�� |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
��1��NaHCO3����ˮ�Լ��ԣ���ԭ����HCO3-+H2O?H2CO3+OH-�������ӷ���ʽ��ʾ����
��2�����������ĸ����жϣ��������Na2CO3��NaHCO3�����ܷ�ȫ���ܽ��ǣ���ǡ�����
��3��������1�����ݵó���Na2CO3��������ˮ���ȣ�NaHCO3��������ˮ���ȣ�����ȡ������ȡ�����
��4����ͬѧ�����������ݵó���Na2CO3��NaHCO3�����ᷴӦ���Ƿ��ȷ�Ӧ����ͬѧ��ΪӦ������һ��ʵ�飬����������ʵ�飺�� ʢ ��10mLˮ��20�棩���ձ��м���10mL�ܶ�ԼΪ1.1g/mL20%�����ᣨ20�棩�����裬�����¶�Ϊ22.2�森
��5���������̽��������˵����ȷ����AC��
A��NaHCO3������ķ�Ӧ�����ȷ�Ӧ
B��������ϡ�������Na2CO3��NaHCO3����
C��Na2CO3��NaHCO3������ϡ���ᷴӦ�������仯�������ʵ��ܽ�������й�
��6����ͬѧΪ�ⶨһ��NaHCO3��Na2CO3��Ϲ�����NaHCO3�Ĵ��ȣ����������ʵ�鷽�������в��ܲⶨNa2CO3��NaHCO3�������Na2CO3������������C
A��ȡa�˻�����ּ��ȣ�����b��
B��ȡa�˻����������ϡ�����ַ�Ӧ�����ȡ����ɡ����գ���b�˹���
C��ȡa�˻����������ϡ�����ַ�Ӧ���ݳ������ü�ʯ�����գ�����b��
D��ȡa�˻����������Ba��OH��2��Һ��ַ�Ӧ�����ˡ�ϴ�ӡ���ɣ���b�˹��壮
����A��������ʵ�飬��ԭ�������NaHCO3����������Ϊ$\frac{84b}{31a}$��100%���ú�a��b�Ĵ���ʽ��ʾ��
�������ܽ�ȱ�
| �¶� �ܽ�� | 10�� | 20�� | 30�� | 40�� |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40��g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
| ��� | �� | �� | �� | �� | �� | �� |
| ������װ��ͼ | 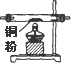 |  |  |  | 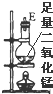 |  |
��1��������Ƶ����������������ʱ������������װ�õ���ȷ����˳���ǣ����װ�õ���ţ�
�۽ӢݽӢܽӢڽӢٽӢޣ����У������װ������ʱ�������ܽӿڣ���װ������ĸ��ʾ��Ӧ�ǽ�C��
��2��װ�â��з�����Ӧ�����ӷ���ʽ��Cl2+2OH-=Cl-+ClO-+H2O��
��3��ʵ�鿪ʼʱ��Ӧ���ȼ���װ�õ������ԣ�ʵ�����ʱ��Ӧ��Ϩ��ٴ��ľƾ��ƣ�
��4����װ�âݵ���ƿ�У�������Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2+2H2O
��5������ַ�Ӧ��װ�âٵIJ������г��ػ�ɫ����ȴ���ƵõIJ��������Һ����Һ���̣������̣�ɫ��
��6������Ӧ����71gCl2���ɣ���������HCl�����ʵ���Ϊ2mol��ת�Ƶ�����Ϊ2NA��
| A�� | �õ�2.54 g����ʱ������NaOH��Һ�������600 mL | |
| B�� | ��Ũ������HNO3�����ʵ���Ũ����14.0 mol/L | |
| C�� | NO2��N2O4 �Ļ�������У�NO2�����������80% | |
| D�� | �úϽ���ͭ��þ�����ʵ���֮����2��1 |


