题目内容
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已
知常温下浓盐酸与高锰酸钾能反应生成氯气.
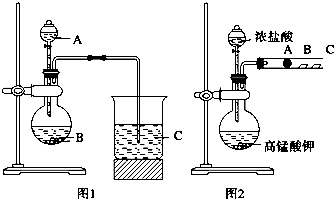
(1)甲同学设计实验的依据是 ;写出选用物质的名称:A ,B ,C ;
(2)乙同学的实验原理是 ;写出A和B处的离子方程式:A处: B处: .B处的现象 ; C处的现象 .
知常温下浓盐酸与高锰酸钾能反应生成氯气.

(1)甲同学设计实验的依据是
(2)乙同学的实验原理是
考点:氯、溴、碘及其化合物的综合应用
专题:实验题
分析:(1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;
(2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物确定实验现象.
(2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物确定实验现象.
解答:
解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硫酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为硫酸,B为碳酸钠溶液,C为硅酸钠溶液,故答案为:最高价氧化物 水化物酸性越强对应元素非金属性越强;硫酸;碳酸钠溶液;硅酸钠溶液;
(2)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是同主族单质氧化性越强阴离子还原性越弱,对应元素非金属越强,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的,即A处:Cl2+2Br-=2Cl-+Br2,B:Cl2+2I-=2Cl-+I2,所以B处的现象变蓝,剩余的氯气能使湿润红纸褪色,即 C处的现象是红色褪色,
故答案为:同主族单质氧化性越强,阴离子还原性越弱,对应元素非金属越强;Cl2+2Br-=2Cl-+Br2;Cl2+2I-=2Cl-+I2;变蓝;红色褪色.
(2)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是同主族单质氧化性越强阴离子还原性越弱,对应元素非金属越强,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的,即A处:Cl2+2Br-=2Cl-+Br2,B:Cl2+2I-=2Cl-+I2,所以B处的现象变蓝,剩余的氯气能使湿润红纸褪色,即 C处的现象是红色褪色,
故答案为:同主族单质氧化性越强,阴离子还原性越弱,对应元素非金属越强;Cl2+2Br-=2Cl-+Br2;Cl2+2I-=2Cl-+I2;变蓝;红色褪色.
点评:本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.

练习册系列答案
相关题目
下列说法正确的是( )
| A、BF3和NF3的空间构型都为平面三角形 |
| B、互为手性异构体的分子的化学式相同 |
| C、熔点:Na-K合金<氯化钠<钠<<金刚石 |
| D、空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积 |
能源可划分为一次能源和二次能源.自然界中以现成形式提供的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源.氢气是一种高效而没有污染的二次能源,它可以由自然界中大量存在的水来制取:2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ/mol.下列叙述正确的是( )
| A、电能是二次能源 |
| B、水力是二次能源 |
| C、天然气是二次能源 |
| D、焦炉气是一次能源 |
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述不正确的是( )
| A、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| B、两种溶液的物质的量浓度不相同 |
| C、分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而 没抗癌作用.对此下列叙述正确的是( )
没抗癌作用.对此下列叙述正确的是( )
 具有抗癌作用,而
具有抗癌作用,而 没抗癌作用.对此下列叙述正确的是( )
没抗癌作用.对此下列叙述正确的是( )| A、两者互为同分异构体,都是以Pt原子为中心的四面体结构 |
| B、两者互为同分异构体,都是以Pt原子为中心的平面结构 |
| C、两者为同一物质,都是以Pt原子为中心的四面体结构 |
| D、两者为同一物质,都是以Pt原子为中心的平面结构 |
