题目内容
7.关于氢键,下列说法正确是( )| A. | 所有含氢元素的化合物中都存在氢键,氢键比范德华力强 | |
| B. | H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 | |
| C. | 氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 | |
| D. | 分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内 |
分析 A.某些含N-H、O-H、F-H的化合物才能形成氢键;
B.氢键只影响物质的物理性质,与化合物的稳定性无关;
C.氢键是X-H…Y形式的键,属于分子间作用力,不属于化学键;
D.氢键的存在使分子间作用力增强,分子间氢键使物质的熔点和沸点升高,氢键存在于分子之间,也存在于分子之内.
解答 解:A.F,O,N等为电负性大而原子半径较小的非金属原子,在某些含N-H、O-H、F-H的化合物中形成氢键,所以含有氢元素不一定有氢键,如甲烷分子间不能形成氢键,故A错误;
B.氢键只影响物质的物理性质,H2O是一种非常稳定的化合物,是因为H-O键的稳定性强,故B错误;
C.氢原子与电负性大、半径小的原子X(氟、氧、氮等)以一种特殊的分子间作用力结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的键,称为氢键,不属于化学键,故C错误;
D.氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点,氢键也可存在于分子内,如邻羟基苯甲醛分子(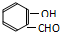 ) 内的羟基与醛基之间即存在氢键,故D正确.
) 内的羟基与醛基之间即存在氢键,故D正确.
故选D.
点评 本题考查了氢键的存在和对物质性质的影响,题目难度不大,把握氢键的概念是解题的关键,注意氢键只影响物质的物理性质,与物质的稳定性无关.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
18.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )

下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品中Fe元素的质量为2.24 g | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
15.下列转化关系不能一步实现的是( )
| A. | Cl2→NaClO | B. | Fe2O3→Fe(OH)3 | C. | Na→Na2SO4 | D. | Cu→CuCl2 |
16.某含K+的溶液中还可能含有NH4+、A13+、Fe3+、Br-、CO32-、I-、SO32-、SO42-中的一种或几种离子.取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉溶液均无现象.为确定该溶液的组成,还需进行的实验有( )
| A. | 取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体 | |
| B. | 取样,逐滴加入NaOH至过量,观察是否先产生白色沉淀后沉淀溶解 | |
| C. | 取样,加足量盐酸加热,用湿润的品红试纸检验气体 | |
| D. | 取样,滴加硫氰化钾溶液 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol Fe在0.1mol Cl2中充分燃烧,转移电子数为0.3NA | |
| B. | 用MnO2与浓盐酸制取Cl2时,每生成1 mol Cl2则转移电子数为NA | |
| C. | 1L 0.1mol•L-1(NH4)2SO4溶液中含有NH4+的数目为0.2 NA | |
| D. | 23g钠在足量氧气中充分燃烧,转移电子数为NA |
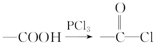
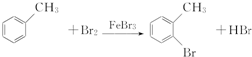 ,E→F的化学方程式为
,E→F的化学方程式为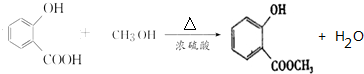 .
.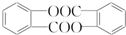 .
.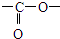 ”结构
”结构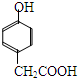 .
.