题目内容
18.下列关于有机物的说法不正确的是( )| A. | 乙烯能使溴的CCl4溶液褪色是因为发生了加成反应反应 | |
| B. | 苯不能使溴的CCl4溶液褪色,说明苯分子中不存在碳碳双键 | |
| C. | 要除去乙酸乙酯中的少量乙酸可以加入少量乙醇和浓硫酸再加热 | |
| D. | 葡萄糖能与新制的氢氧化铜反应,说明葡萄糖是还原性糖 |
分析 A.乙烯中含有碳碳双键,能和溴发生加成反应;
B.双键可以反应加成反应;
C.乙酸与乙醇的酯化反应为可逆反应,不能得到纯净物;
D.醛基能和新制氢氧化铜悬浊液发生氧化反应.
解答 解:A.乙烯中含有碳碳双键,能和溴发生加成反应而使溴的四氯化碳褪色,该反应为加成反应,故A正确;
B.苯不能因发生化学反应而使溴的四氯化碳溶液褪色说明不存在双键,说明苯分子中不存在碳碳单、双键的交替结构,故B正确;
C.乙酸与乙醇的酯化反应为可逆反应,不能得到纯净物,饮用饱和碳酸钠溶液除杂,故C错误;
D.醛基能和新制氢氧化铜悬浊液发生氧化反应,葡萄糖中含有醛基,所以能被新制氢氧化铜悬浊液氧化,说明葡萄糖具有还原性,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意乙酸乙酯制取中除杂剂及除杂方法,题目难度不大.

练习册系列答案
相关题目
8. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
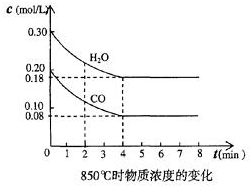
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
9.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 往CaCl2溶液中通入少量的CO2 Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
6.2H、13C、15N、18O、34S等常用作环境分析指示物,下列对它们的说法正确的是( )
| A. | 34S原子核内的中子数为16 | B. | 16O与18O互称同位素 | ||
| C. | 13C和15N原子核内的质子数相差2 | D. | 2H的核外电子数比1H多一个 |
13.25℃时,pH=13的氨水溶液,下列说法不正确的是( )
| A. | 溶液中C(OH-)=0.1mol•L-1 | B. | 溶液中C(OH-)>C(H+) | ||
| C. | 该氨水的浓度为0.1mol•L-1 | D. | 溶液中水的离子积为1×10-14 |
3.用NA表示阿伏伽德罗常数,下列说法不正确的是( )
| A. | 常温常压下,16gO2所含的原子数NA | |
| B. | 标准状况下,2.24L水所含的电子数为10NA | |
| C. | 2.4g金属镁与足量盐酸反应失去电子数0.2NA | |
| D. | 1.6g甲烷含有共用电子对数目0.4NA |
10.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 浓盐酸与MnO2共热产生22.4L Cl2时,转移电子数为2NA | |
| C. | 0.5 mol•Lˉ1MgCl2溶液中,含有Clˉ个数为NA | |
| D. | 18 g NH4+中所含的质子数为10NA |
7.下列属于正确的电离方程式是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | NaHCO3?Na++HCO3- | D. | H2S?2H++S2- |
8.能说明NH3分子的空间构型是三角锥形而不是平面正三角形的充分理由是( )
| A. | NH3与H+反应生成的NH4为正四面体结构 | |
| B. | NH3分子内3个共价键的键角、键长相等 | |
| C. | NH3分子内3个共价键的键长相等,3个键角都等于107° | |
| D. | NH3分子内3个共价键的键长相等,3个键角都等于120° |