题目内容
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 2.8g铁粉在1.12L(标准状况下)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 标准状况下22.4LSO3含氧原子数为3NA | |
| C. | 10g H218O中所含的中子数为5NA | |
| D. | 11.2L 的CO气体与0.5molN2所含的电子数相等 |
分析 A、2.8g铁粉即0.05mol铁粉,在标况下1.12L氯气即0.05mol氯气中燃烧时,铁粉过量;
B、标况下三氧化硫为固态;
C、求出H218O的物质的量,然后根据1molH218O中含10mol中子来分析;
D、CO所处的状态不明确.
解答 解:A、2.8g铁粉即0.05mol铁粉,在标况下1.12L氯气即0.05mol氯气中燃烧时,铁粉过量,而氯气反应后变为-1价,故0.05mol氯气得到0.1NA个电子,即铁失去0.1NA个电子,故A错误;
B、标况下三氧化硫为固态,故不能根据其体积来计算其物质的量和含有的原子个数,故B错误;
C、10gH218O的物质的量为0.5mol,而1molH218O中含10mol中子,故0.5mol水中含5NA个中子,故C正确;
D、CO所处的状态不明确,故其物质的量无法计算,则其含有的电子数也无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
4.下列混合物适合用过滤的方法进行分离的是( )
| A. | 糖中混有少量食盐 | B. | 氯化钠中混有少量泥沙 | ||
| C. | 食盐中混有少量硝酸钾 | D. | 水中混有酒精 |
18.实验室用牛油、乙醇、氢氧化钠等物质,按一定顺序、一定比例混合共热可以制备肥皂,下列有关皂化实验的叙述中不正确的是( )
| A. | 乙醇的作用是为了在微热下溶解牛油 | |
| B. | 加入氢氧化钠溶液,边搅拌边小心加热,反应液逐渐变成黄棕色黏稠状 | |
| C. | 蘸取反应液,滴入热水中,若无油滴浮在液面上说明已完全反应 | |
| D. | 完全反应后,加入热的饱和食盐水,有固体析出,固体沉于液面下 |
5.下列各组既不是同系物,又不是同分异构体的是( )
| A. | 乙烯和2-丁烯 | B. | 苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 异丁烷和正戊烷 |
2.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | 醋酸溶液 | B. | 豆浆 | C. | 氢氧化铁沉淀 | D. | 蔗糖 |
3.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
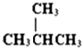 和
和 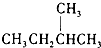 J、
J、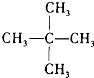 和
和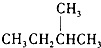
 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.