题目内容
19.(1)1.5mol HNO3约含有4.5NA个氧原子,含0.6mol H 的C6H12O6的物质的量是0.05mol.(2)22克CO2的物质的量为0.5mol,该气体在标准状况下的体积为11.2L.
(3)4gNaOH固体的物质的量为0.1mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为0.2mol/L.
(4)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是0.25mol/L.
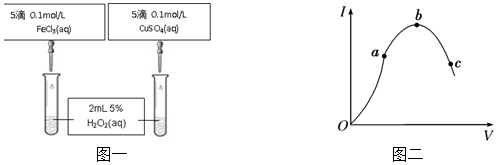
(5)实验室制备Fe (OH)3胶体的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
分析 (1)根据N=nNA计算出含有氧原子数目;C6H12O6的物质的量n(C6H12O6)=$\frac{1}{12}$n(H);
(2)根据n=$\frac{m}{M}$计算出22g二氧化碳的物质的量,根据V=nVm计算出标准状况下该二氧化碳的体积;
(3)根据n=$\frac{m}{M}$计算出氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的浓度;
(4)根据稀释过程中溶质的物质的量不变计算出稀释后溶液浓度;
(5)实验室中将饱和氯化铁溶液加入沸水中制取氢氧化铁胶体,据此书写化学方程式.
解答 解:(1)1.5molHNO3约含有4.5molO原子,N(O)=4.5NA,含0.6molH的C6H12O6的物质的量是:n(C6H12O6)=$\frac{1}{12}$n(H)=$\frac{0.6mol}{12}$=0.05mol,
故答案为:4.5NA;0.05;
(2)n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,该气体在标准状况下的体积为:0.5mol×22.4L/mol=11.2L,
故答案为:0.5;11.2;
(3)4g氢氧化钠的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为:$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2mol/L;
(4)将5mol/L盐酸10mL稀释到200mL,稀释过程中HCl的物质的量不变,则稀释后溶液的物质的量浓度是:$\frac{5mol/L×0.01L}{0.2L}$=0.25mol/L,
故答案为:0.25mol/L;
(5)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
点评 本题考查了物质的量的计算、化学方程式书写,题目难度中等,明确物质的量与摩尔质量、气体摩尔体积、物质的量浓度之间的关系为解答关键,注意掌握氢氧化铁胶体的制备方法,试题培养了学生的灵活应用能力.

| A. | 15.5 g•mol-1 | B. | 85 g•mol-1 | C. | 55 | D. | 55 g•mol-1 |
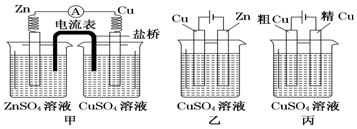
| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙装置中,铜极因发生氧化反应而溶解 | |
| D. | 乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 |
| A. | 钠的摩尔质量等于它的相对原子质量 | |
| B. | CH4的摩尔质量为16 g/mol | |
| C. | 22.4 L任何气体的物质的量均为1 mol | |
| D. | 1 mol 任何物质均含有NA个分子 |
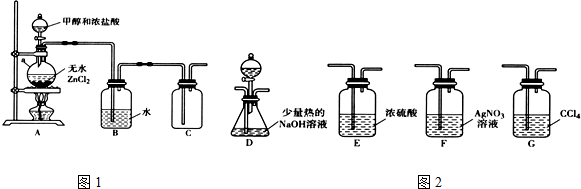
①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3 _ mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和图2所示的部分装置检验CH3Cl中的氯元素.
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A→B→F→D→G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银溶液.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
③将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.