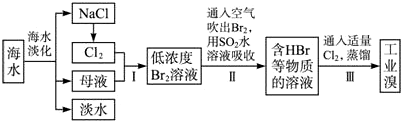
题目内容
7.埋藏在地下的古青铜器锈蚀过程可以表示为Cu$\stackrel{O_{2},Cl-}{→}$CuCl$\stackrel{H_{2}O}{→}$Cu2O-→X,X由两种物质X1和X2组成,且都由四种元素构成,定性实验表明:X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生.为了定量测定X1和X2组成,某兴趣小组用如图实验装置对X1和X2分别做热分解实验(夹持装置已省去),实验结束后,硬质玻璃管内均残留黑色固体,分别称重,装置B和C中的质量均增加.
请回答下列问题:
(1)古代青铜器出土后防止青铜器继续锈蚀的关键是与H2O和O2隔绝.
(2)利用上述装置进行热分解实验时,对判断A装置中反应是否完全进行带来困难,为解决此问题,要对B装置进行改装.B应改为内装有浓硫酸(填试剂名称)的洗气瓶,判断反应完全的现象为洗气瓶中不再有气泡冒出.用经改装的装置,某同学进行正确操作,最终得出的测定结果仍有误差,原因是实验前装置内空气中的某些成分干扰了实验或反应结束后装置内的气体没有被B和C完全吸收(回答一点即可).
(3)在实验装置和实验操作正确的前提下,重做X1的热分解实验,测得装置B和C中质量增重之比△m(B):△m(C)=9:22,能(填“能”或“否”)求出X1的化学式,若能求出X1的化学式,则化学式为Cu2(OH)2CO3 (或不能求出X1的化学式,此空不填).
(4)若测得X2中铜元素的质量分数为59.5%(铜元素的相对原子质量为63.5),则X2的化学式为Cu2(OH)3Cl;X2热分解的化学方程式为Cu2(OH)3Cl=2CuO+H2O↑+HCl↑..
分析 (1)铜与空气中的氧气、二氧化碳和水等物质反应产生铜锈(铜绿),据此答题;
(2)B装置改为洗气瓶装置,依据气体冒出的现象判断是否反应完全;
(3)X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生,说明都是碱式盐;B吸收水,C吸收二氧化碳;△m(B):△m(C)=9:11,X由两种物质X1和X2组成,且都由四种元素组成,实验结束后,硬质玻璃管内均残留黑色固体判断为CuO,结合原子守恒计算得到;
(4)先通过定性实验判断X1和X2的元素组成,加热分解均有水珠生成,说明都是碱式盐,X1受热分解产生CO2气体,说明X1中含有CO32-,因此X1的组成可表示为Cuz(OH)x(CO3)y,X2(由4种元素构成)受热分解无CO2气体生成,根据结构CuCuClCu2O-→X,可推测X2中含有的另一元素为Cl,X2的组成可表示为Cuz(OH)xCly.
解答 解:(1)铜与空气中的氧气、二氧化碳和水等物质反应产生铜锈(铜绿),所以要防止青铜器接触潮湿的空气,
故答案为:与H2O和O2隔绝;
(2)利用上述装置进行热分解实验时,对判断A装置中反应是否完全进行带来困难,为解决此问题,依据气体冒出的现象判断是否反应完全,要对B装置进行改装,换做盛有浓硫酸的洗气瓶,当瓶内到期滚无气泡冒出说明反应完全,最终得出的测定结果仍有误差的原因为:实验前装置内空气中的某些成分干扰了实验或反应结束后装置内的气体没有被B和C完全吸收;
故答案为:浓硫酸;洗气瓶中不再有气泡冒出;实验前装置内空气中的某些成分干扰了实验或反应结束后装置内的气体没有被B和C完全吸收;
(3)X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生;B吸收水,C吸收二氧化碳;△m(B):△m(C)=9:11,物质的量之比为:n(H2O):n(CO2)=$\frac{9}{18}$:$\frac{11}{44}$=2;1,反应分解生成水和二氧化碳,硬质玻璃管内均残留黑色固体为CuO,由四种元素组成,则X1分解为CuO+2H2O+CO2结合原子守恒得到Cu2(OH)2CO3;
故答案为:能;Cu2(OH)2CO3 ;
(4)测得X2中铜元素的质量分数为59.5%(铜元素的相对原子质量为63.5),X2热分解的产物不能使澄清石灰水变浑浊,说明不含有碳元素,但有水珠产生说明含有氢元素和氧元素,X2的组成为Cuz(OH)xCly,铜元素的质量分数的表达式为$\frac{63.5z}{M}$×100%=Cu%=59.5%,又根据化合价代数和等于0可得63.5z+17x+35.5y,2z=x+y,解得x:y=3:1,故X2的化学式为Cu2(OH)3Cl.结合题中性质和现象不难写出热分解的化学方程式:Cu2(OH)3Cl,Cu2(OH)3Cl=2CuO+H2O↑+HCl↑.
故答案为:Cu2(OH)3Cl,Cu2(OH)3Cl=2CuO+H2O↑+HCl↑.
点评 本题考查了物质组成的分析,物质性质的反应产物判断方法,实验过程的理解应用,化学式的计算分析,掌握基础是关键,题目难度较大.

①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O⑤NaH和H2O ⑥Cl2和H2O ⑦NO2和H2O.
| A. | ①⑤⑦ | B. | ③④⑤⑥⑦ | C. | ③⑥⑦ | D. | ②③⑤ |
| A. |  | B. |  | C. |  | D. |  |
| A. | C12 | B. | NH3 | C. | BaCO3 | D. | C2H5OH (乙醇) |
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
| A. |  制备氢氧化亚铁并观察其颜色 | B. |  气密性检 | ||
| C. |  制备并检验氢气的可燃性 | D. |  浓硫酸稀释 |