题目内容
11.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 16 g O2和O3的混合气体中,所含氧原子数为0.5NA | |
| C. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| D. | 9g D2O所含的中子数为4.5NA |
分析 A.氦气为单原子分子;
B.氧气和臭氧分子中都只含有氧原子,据此计算出混合气体中含有的氧原子数目;
C.根据氯气与铁反应生成的是氯化铁分析;
D.重水的摩尔质量为20g/mol,计算出重水的物质的量及含有的中子数.
解答 解:A.标准状况下,1.12L氦气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,含有原子数为0.05NA,故A错误;
B.16g氧气和臭氧的混合气体中含有16g氧原子,含有1mol氧原子,所含的氧原子数为NA,故B错误;
C.5.6g铁的物质的量为0.1mol,与足量的氯气反应生成0.1mol氯化铁,失去0.3mol电子,电子转移0.3NA个,故C错误;
D.9g重水的物质的量为0.45mol,含有4.5mol中子,所含的中子数为4.5NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意标准状况下条件要求及物质的状态,重水的摩尔质量为20g/mol,注意氦气为单原子分子,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
1.某化学兴趣小组设计如下实验方案.将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
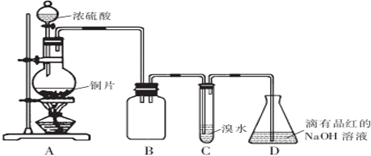
请回答下列问题:
(1)装置B的作用是防倒吸
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应Ⅱ.NaClO不足Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成
下表:(已知酸性:H2SO3>H2CO3>HCl0)

请回答下列问题:
(1)装置B的作用是防倒吸
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应Ⅱ.NaClO不足Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成
下表:(已知酸性:H2SO3>H2CO3>HCl0)
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液呈紫色 | Ⅰ或者Ⅲ |
19.一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)?2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③混合气体的平均摩尔质量不再发生变化
④单位时间内生成n mol Z,同时生成2n molY.
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③混合气体的平均摩尔质量不再发生变化
④单位时间内生成n mol Z,同时生成2n molY.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①④ |
3.NA代表阿伏加德罗常数,下列说法一定正确的是( )
| A. | 在标准状况下,22.4L水的质量约为18g | |
| B. | 1.7g氨气所含原子数目为0.4NA | |
| C. | 同温同压时,相同体积的任何气体单质所含的原子数相同 | |
| D. | 1 L 1mol•L-1的Na2SO4溶液中含Na+的个数为NA. |
20.判断物质在不同溶剂中的溶解性时,有一条经验规律:“极性分子组成的溶剂易溶解极性分子组成的溶质;非极性分子组成的溶剂易溶解非极性分子组成的溶质.”下列如图装置中,不宜用作HCl尾气吸收的是( )
| A. |  | B. |  | C. |  | D. | 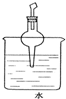 |
1.短周期元素中的元素X原子的2p轨道和元素Y的3p轨道均有2个成单电子,则下列分析中正确的是( )
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |

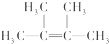 ;
;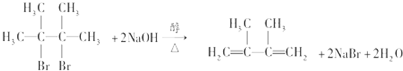 ;
; .
.